Химические свойства
1. Реакции замещения в бензольном кольце
Первая группа реакций — реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство — галогенирование. Замещение атома водорода на атом галогена — хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
![]()
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
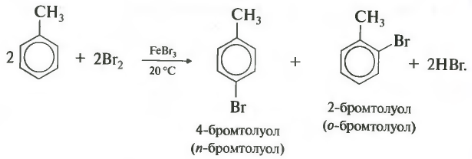
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
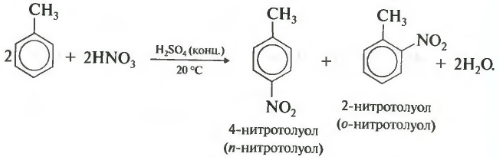
Второе свойство — нитрование бензола, введение нитрогруппы в бензольное кольцо.
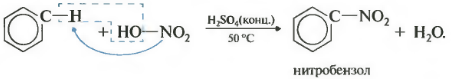
Образуется тяжелая желтоватая жидкость с запахом горького миндаля — нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство — алкилирование бензола галогеналканами.
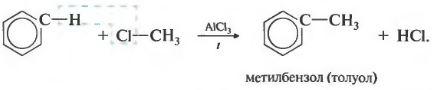
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство — алкилирование бензола алкенами.
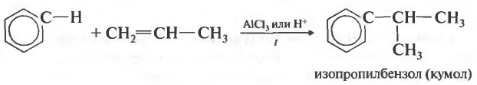
Таким способом можно получить, например, кумол или же этилбензол. Катализатор — хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций — реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке — гидрирование, присоединение водорода.
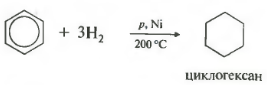
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство — хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
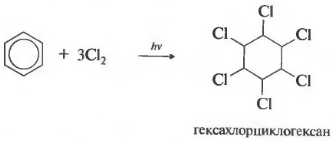
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола — это замещение в боковой цепи.
Седьмое свойство в общем списке — галогенирование по альфа-атому углерода в боковой цепи.
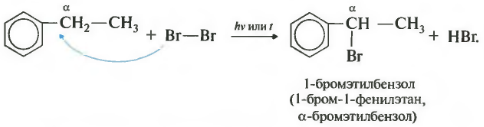
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций — окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия — не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
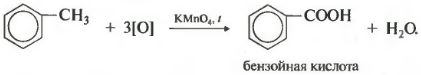
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
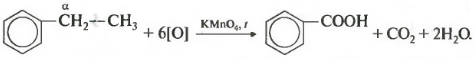
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам — окисляется углерод, находящийся в альфа-положении.
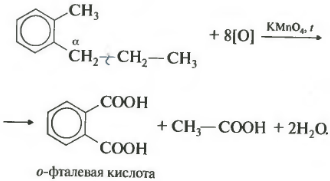
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
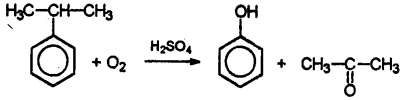
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство — горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
![]()
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же — 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.