Участие спиртов в химических реакциях будет обуславливаться разрывом либо С–О, либо О–Н связей. В первом случае протекают реакции замещения всей функциональной группы, а во втором — замещение только протона (кислотные свойства). Также могут происходит реакции по углеводородному радикалу, не затрагивая функциональную группу (Е.7.25):
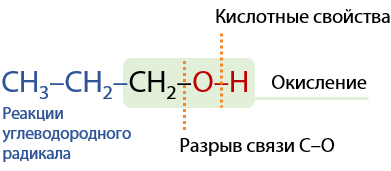
Спирты слабее проявляют кислотные свойства, чем вода, за счет положительного индуктивного эффекта алкильной группы (она является донором электронной плотности и уменьшает полярность связи О–Н). Если же гидроксильная группа будет соединена с более электроотрицательным атомом, чем углерод, то кислотные свойства таких соединений будут усиливаться (Г.7.26):
Заметьте, что увеличение степени окисления атома, к которому присоединена ОН-группа, также приводит к усилению кислотных свойств.
Проявляются слабо, окраска индикаторов не изменяется в растворе спирта. Спирты могут взаимодействовать со щелочными металлами с выделением водорода (Г.7.27):
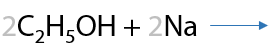

Главное условие: спирт должен быть абсолютным, т.е. не иметь воду в качестве примесей. При наличии воды полученные алкоголяты щелочных металлов будут гидролизоваться с образованием спиртов (Г.7.28):
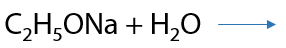
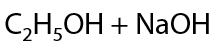
Обратите внимание: гидролиз алкоголятов необратимый процесс, спирты не реагируют со щелочами!
Необратимая реакция. Взаимодействие алкоголятов и галогеналканов проходит с образованием простого эфира и побочного продукта — неорганической соли. В качестве галогеналканов обычно используют иодалканы (Е.7.29):
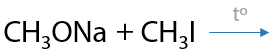
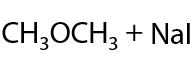
Обратимое взаимодействие. Реакция проходит только с HBr или HCl и проводится в присутствии концентрированной серной кислоты H2SO4, которая выполняет роль катализатора и обезвоживающего агента за счет гигроскопичности (Г.7.30):
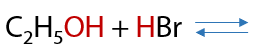

Такое же замещение может произойти при одновременном действии на спирт хлорида или бромида щелочного металла и концентрированной H2SO4. На первой стадии реакции взаимодействуют соль и кислота, образуя хлороводород HCl или бромоводород HBr и гидросульфат щелочного металла. На второй стадии происходит взаимодействие галогеноводорода и спирта по ионному механизму замещения (Е.7.31):


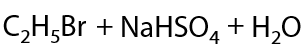
Взаимодействие спиртов с карбоновыми кислотами R–COOH с образованием сложных эфиров. Обратимая реакция, катализатор — минеральная кислота, например серная H2SO4 (Г.7.32):


Помимо органических карбоновых кислот могут применяться также и неорганические (7.33):


Применение концентрированной серной кислоты также может привести к образованию сложного эфира (межмолекулярная дегидратация). Например, именно по такой реакции получают лаурилсульфат и в дальнейшем лаурилсульфат натрия — чистящее и смачивающее средство, применяемое в косметике и бытовой химии (Г.7.34):


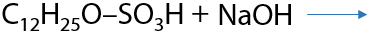
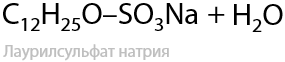
Обратимая реакция, проходит при нагревании и присутствии катализатора-кислоты. При сильном нагревании t>140 oC происходит внутримолекулярная дегидратация с образованием алкенов (Г.7.35):

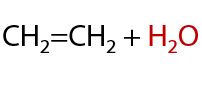
При использовании вторичных или третичных спиртов отщепление молекулы воды проходит по правилу Зайцева (Г.7.36):
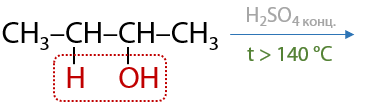

При слабом нагревании t<140 oC происходит межмолекулярная дегидратация с образованием простых эфиров (Г.7.37):
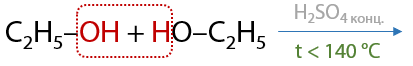
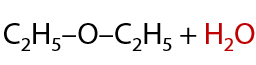
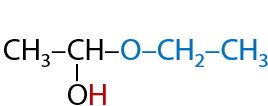
Спирты могут присоединяться по карбонильной группе за счет наличия на атоме кислорода в ОН-группе неподеленной электронной пары (7.38):
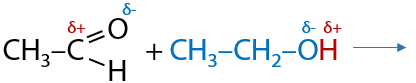
Мягкое окисление проводится с помощью медного катализатора и повышенной температуры или с помощью оксида меди (II), а жесткое окисление — типичными сильными окислителями KMnO4/K2Cr2O7.
Первичные спирты при мягком окислении будут образовывать альдегиды. Признак реакции — появление цветочного или фруктового запаха (Е.7.39):


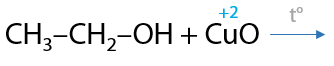

Те же спирты, но с использованием жестких окислителей, будут превращаться в карбоновые кислоты, если процесс проводится в кислой среде (Г.7.40):
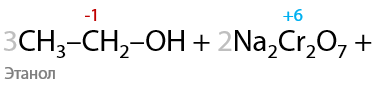
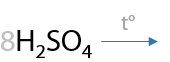
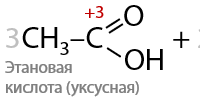
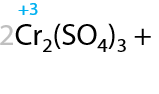
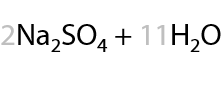
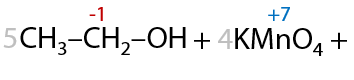


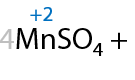
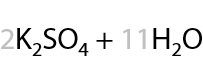
При проведении окисления в щелочной среде образуются соли соответствующих карбоновых кислот (7.41):
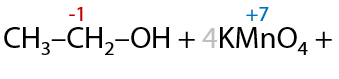



Вторичные спирты при использовании любого вида окисления будут образовывать кетоны (Г.7.42):
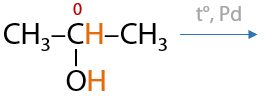
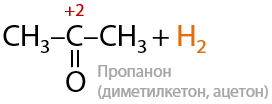
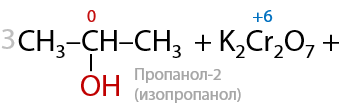
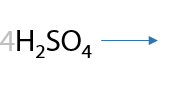
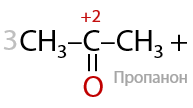
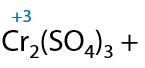
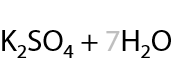
Третичные спирты почти не подвергаются окислению даже при использовании стандартных окислителей, и этот процесс проходит всегда с разрывом С–С связей (Е.7.43):
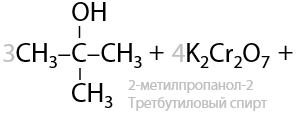
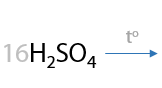
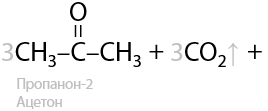

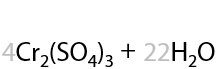
Для окисления третичных спиртов (реакция из ЕГЭ) часто применяют концентрированную азотную кислоту HNO3, иногда для ускорения процесса применяют катализатор — сульфат марганца MnSO4:


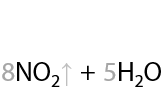
Горение спиртов проходит с образованием углекислого газа и воды. В результате горения выделяется большое количество теплоты — процесс экзотермический (Р.7.45):

Качественная реакция на спирты с фрагментом CH3–CH(OH)–. Для прохождения реакции обязательно присутствие метильной группы. Под действием щелочного раствора иода на спирт образуется желтоватый осадок иодоформа CHI3 с «больничным» запахом (7.46):

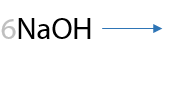

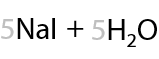

Подобная реакция происходит при действии хлора на спирты с метильным фрагментом. Побочным продуктом является хлороводород (Е.7.47).
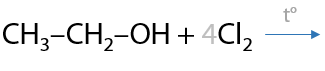

Вопрос по теме: