Свойства фенолов сильно отличаются от одноатомных спиртов, т. к. кислотные свойства фенолов выражены сильнее за счет наличия бензольного кольца.
Фенолы не вступают в реакции дегидратации, не вступают в реакции замещения гидроксильной группы и легче подвергаются окислению по сравнению со спиртами.
При введении в ароматическое кольцо фенолов некоторых заместителей могут изменяться их кислотные свойства. При введении заместителей, стягивающих электронную плотность (акцепторных), кислотные свойства усиливаются. А при введении заместителей, донирующих электронную плотность, наоборот, кислотные свойства уменьшаются (Г.9.15):
Исходя из закономерности, можно сделать вывод, что гомологи фенола имеют более слабые кислотные свойства.
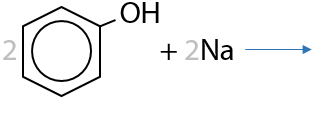
Обратимая реакция. Как и спирты, при взаимодействии с металлами происходит замещение атома водорода в гидроксильной группе и образуются молекулярный водород Н2 и соль (в случае фенола — фенолят щелочного металла) (Г.9.16):

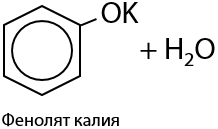
Феноляты легко гидролизуются водой с высвобождением исходного фенола (Г.9.17):
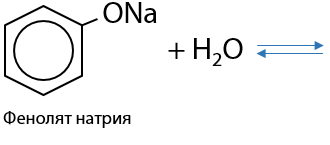
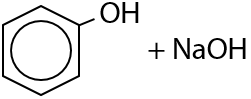
Поэтому раствор фенолята натрия имеет слабощелочную реакцию среды и изменяет окраску индикаторов.
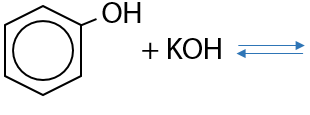
Обратимая реакция. В реакции щелочи с фенолом также образуются феноляты, а побочный продукт — вода (Г.9.18):
По сравнению с бензолом у фенолов электрофильное замещение проходит намного легче, что обеспечивается за счет +М эффекта гидроксильной группы (см. раздел «Строение фенолов»). Происходит активирование орто- и пара-положений, и замещение происходит по всем трем даже без катализаторов.
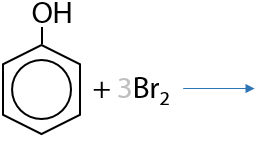
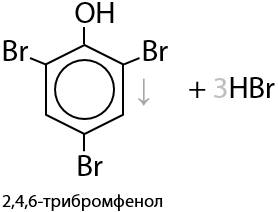
Качественная реакция. Фенол реагирует с бромной водой без катализаторов сразу по трем положениям с образованием белого осадка (Г.9.19):
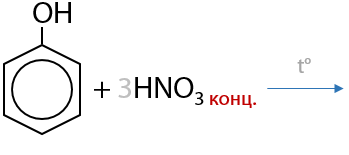
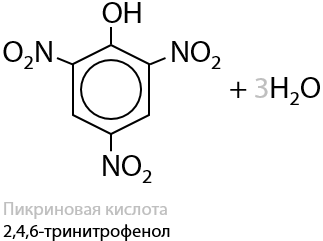
Взаимодействие с азотной кислотой также не требует наличия катализаторов и проходит по всем трем положениям одновременно (Г.9.20):
При использовании разбавленной азотной кислоты (примерно 30 %-й) возможно получение мононитропроизводных (Е.9.21):
В процессе нитрования происходит сильный разогрев смеси, а получаемый продукт — пикриновая кислота — является взрывоопасным веществом и сильной кислотой (примерно в 100 раз сильнее фосфорной кислоты).
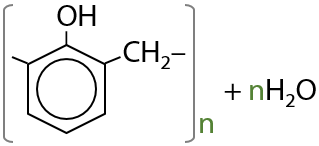
Фенол вступает в реакцию с формальдегидом в присутствии кислотных или основных катализаторов с образование фенолформальдегидных смол — полимерных структур с разветвленным строением (Г.9.22):

Фенолы подвержены окислению даже на воздухе. Именно поэтому белые кристаллы фенола при хранении начинают расплываться и розоветь. Легче всего под воздействием окислителей превращаются двухатомные фенолы (Е.9.23):


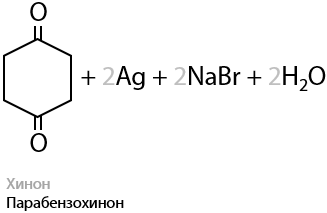
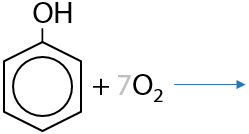
Происходит до углекислого газа и воды (9.24):
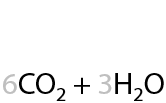
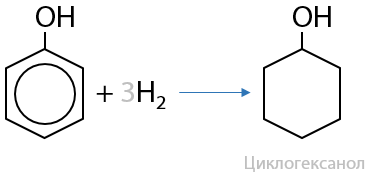
Фенол способен реагировать с водородом, такую реакцию можно использовать как связь класса фенолов и одноатомных спиртов. Основной продукт реакции — циклогексанол. Реакция часто встречается в №32 ЕГЭ:
Это первая стадия в процессе получения капрона, который используется в приборостроении, медицине, а также при изготовлении веревок или одежды.
За счет проявления кислотных свойств фенолы не могут вступать в реакции с карбоновыми кислотами с образованием сложных эфиров.
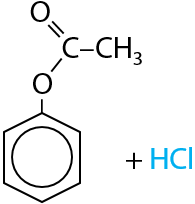
Чтобы получить сложный эфир на основе фенола, необходимо использовать галогенангидриды соответствующих карбоновых кислот (Г.9.25). Побочный продукт при этом взаимодействии — хлороводород.

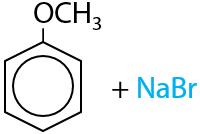
При использовании фенолятов щелочных металлов также можно получать и простые эфиры. Необходимо в спиртовом растворе подействовать на них галогеналканом, обычно бром- или иодпроизводными (Е.9.26):

Является одной из самых распространенных качественных реакций на фенол. Качественный признак: интенсивно окрашенные синие комплексные соединения (Р.9.27).

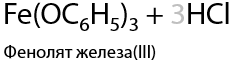
Причем окраска комплексных соединений зависит от природы используемых фенолов и может колебаться от фиолетовой до зеленой.
Вопрос по теме: