Общий взгляд на структурную формулу карбоновых кислот может подсказать, какие свойства для них характерны, основываясь на знании свойств прошлых классов органических соединений (Е.12.44):
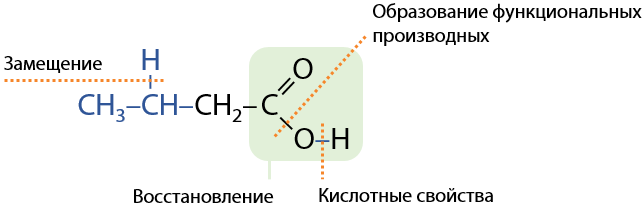
Кислотные свойства карбоновых кислот проявляются в способности их диссоциации с образованием соответствующих анионов и протонов в водном растворе (Г.12.45):

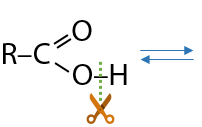

Кислотные свойства представителей этого класса органических соединений зависят от полярности связи –ОН группы в карбоксильном фрагменте. Чем длиннее радикал при функциональной группе, тем меньше полярность связи и меньше кислотные свойства (Е.12.46):
При наличии в углеводородном заместителе электроноакцепторных групп электронная плотность с карбоксильной группы стягивается и полярность связи –ОН группы увеличивается, что приводит к усилению кислотных свойств (Е.12.47):
При наличии углеводородного заместителя при карбоксильной –СООН группе возможно проявление алкановых свойств — замещение атомов водорода. Карбоксильная группа стягивает электронную плотность с углеводородного заместителя из-за наличия двух атомов кислорода и их отрицательного индуктивного эффекта (−I), а значит замещение атомов водорода происходит проще при атомах углерода, стоящих ближе к –СООН группе (Г.12.48):
Казалось бы, наличие карбонильного фрагмента в карбоксильной группе (см. раздел «Строение карбоновых кислот) должно обеспечивать возможность протекания процессов присоединения. Влияние гидроксильного фрагмента и его положительный мезомерный эффект (+М) уменьшают положительный заряд на атоме углерода карбоксильной группы и, как следствие, вместо присоединения протекают процессы замещения –ОН фрагмента (Г.12.49):
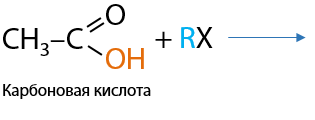

Сильные карбоновые кислоты, например муравьиная, как и типичные сильные неорганические кислоты может вступать в реакцию замещения с металлами (Р.12.50). В качестве побочного продукта выделяется молекулярный водород:
![]()
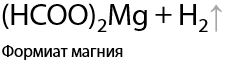
По тому же принципу взаимодействие карбоновых кислот может происходить и с оксидами. Реакция идет медленнее, чем с неорганическими кислотами (Р.12.51):
![]()

В результате взаимодействия образуются соли карбоновых кислот и вода в качестве побочного продукта (Г.12.52):
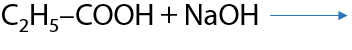

Реакция протекает только, если неорганическая соль образована более слабой, чем используемая органическая, или летучей, или неустойчивой кислотами (Р.12.53):
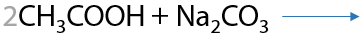
![]()
![]()
При использовании сильных восстановителей, например литийалюмогидрида LiAlH4, или молекулярного водорода карбоксильная группа –СООН может быть восстановлена до спиртового фрагмента –СН2–ОН (Е.12.54):
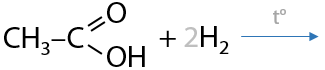

Реакция Дюма. При нагревании твердых соли карбоновой кислоты и гидроксида натрия происходит «отщепление» карбоната натрия и образование алкана с количеством атомов углерода на один меньшим, чем в исходной карбоновой кислоте (Г.12.55):



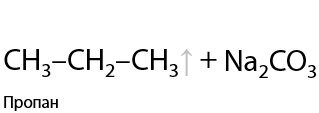
Заметьте, что строение углеводородного заместителя при образовании алкана не изменяется.
Электролиз по Кольбе. При электролизе солей щелочных металлов на катоде выделяется молекулярный водород, а на аноде происходит выделение алкана и углекислого газа из-за процесса удвоения углеводородного заместителя и разложения аниона карбоновой кислоты соответственно. Общий вид электролиза (Е.12.56):
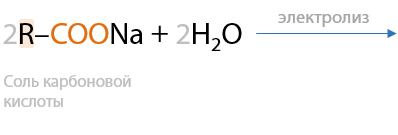


Электролиз раствора пропионата натрия приводит к получению бутана (Е.12.57):


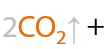
![]()
Заметьте, что алканы, полученные в результате электролиза, имеют симметричное строение.
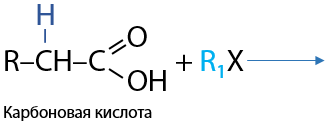
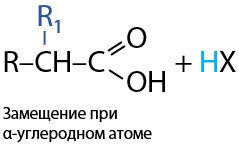
Реакция Геля-Фольгорда-Зелинского. Не зависимо от длины углеводородного радикала замещение атома водорода на галоген происходит при α-углеродном атоме, т. к. именно с него карбоксильная группа в большей степени стягивает электронную плотность (Е.12.58):

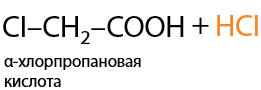
Функциональные производные карбоновых кислот — соединения, в которых гидроксильный фрагмент карбоксильной группы замещен на какую-либо другую функциональную группу (Г.12.59):
Также к функциональным производным относят и нитрилы, имеющие общее строение (Г.12.60):

При взаимодействии карбоновой кислоты со спиртом образуется сложный эфир. Спирт замещает в карбоновой кислоте гидроксильную групп и в качестве побочного продукта образуется вода (Е.12.61):

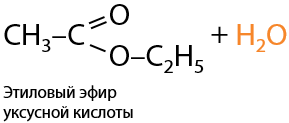
При действии гигроскопичных веществ или водоотнимающих средств, например концентрированной фосфорной кислоты H3PO4 или оксида фосфора (V) P4O10, может произойти межмолекулярная дегидратация, в результате которой и образуется ангидрид карбоновой кислоты (Е.12.62):


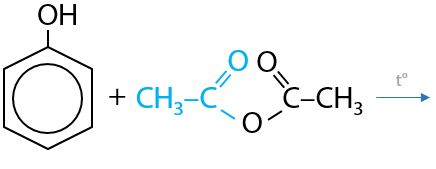
Ангидриды карбоновых кислот часто используются в органических синтезах как ацилирующие агенты, т. е. они осуществляют ввод ацильной группы R–C(O)– в вещества. Например, таким способом можно получить сложные эфиры на основе фенола (Г.12.63):

Карбоновые кислоты при взаимодействии с пентахлоридом фосфора PCl5 образуют хлорангидриды, а в качестве побочного продукта выделяется оксохлорид фосфора POCl3 и хлороводород (Е.12.64):
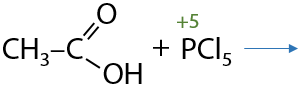

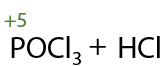
Хлорангидриды также как и ангидриды используются в качестве ацилирующих агентов в органическом синтезе.
При взаимодействии галогенангидридов с аммиаков при нагревании (Г.12.65). Побочный продукт реакции — галогеноводород.
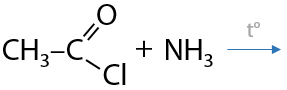

Амиды легко подвергаются дегидратации с помощью пентаоксида фосфора или других водоотнимающих средств с образованием нитрилов (Г.12.66):
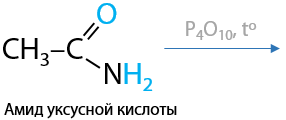
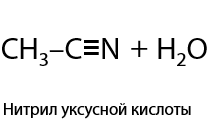
Амиды и нитрилы подвержены гидролизу (идет медленно даже при нагревании), в результате их взаимодействия с водой в кислой среде образуются исходные карбоновые кислоты.
Муравьиная кислота — первый представитель класса карбоновых кислот, не имеющий углеводородного заместителя. Муравьиная кислота относится еще и к классу альдегидов (Г.12.67):

Муравьиная кислота представляет собой бесцветную жидкость с резким запахом. Она ядовита, при попадании на кожу вызывает ожоги. Ее температура кипения 100,6 °C, что выше, чем у воды, а значит в чистом виде ее получить не представляется возможным — муравьиная кислота всегда встречается в смеси с водой.
При смешении муравьиной кислоты с концентрированной серной кислотой происходит отщепление воды и образование монооксида углерода (Г.12.68):
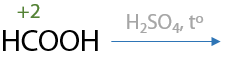

При нагревании формиата натрия происходит отщепление молекулярного водорода с образованием оксалата натрия (Е.12.69):


За счет наличия альдегидного фрагмента в составе муравьиной кислоты она может вступать во взаимодействие с аммиачным раствором оксида серебра (реактивом Толленса). В результате взаимодействия образуется атомарное серебро в виде серебряного налета, в котором видно отражение, и гидрокарбонат аммония (Р.12.70):
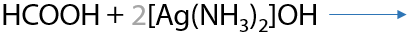
![]()
![]()
Альдегидный фрагмент подвергается окислению всевозможными окислителями и даже кислородом воздуха, при чем схематически можно изобразить изменения структуры муравьиной кислоты (12.71):

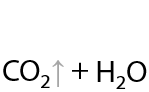
При взаимодействии с перманганатом калия в кислой среде образуется углекислый газ (Г.12.72):

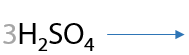
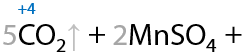
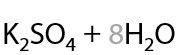
Нестандартное окисление можно провести с применением хлора (12.73). Заметьте, что вода в качестве побочного продукта не образуется:
![]()
![]()
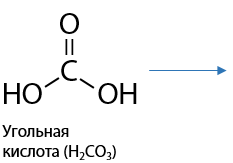
Щавелевая кислота — первый представитель класса двухосновных кислот. Щавелевая кислота может образовывать кристаллогидраты H2C2O4 · 2H2O, она растворима в воде и проявляет восстановительные свойства.
Две карбоксильные группы взаимно влияют друг на друга и стягивают электронную плотность, что обеспечивает наличие более сильных кислотных свойств по сравнению с одноосновными предельными карбоновыми кислотами.
Щавелевая кислота проявляет восстановительные свойства за счет атомов углерода в промежуточной степени окисления. При взаимодействии с перманганатом калия в кислой среде образуется углекислый газ (Г.12.74):

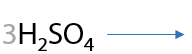


Неустойчивая степень окисления атомов углерода в составе щавелевой кислоты обеспечивает возможность диспропорционирования в кислой среде (Г.12.75):

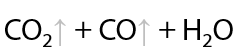
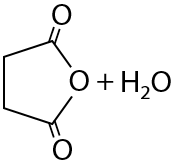
Дикарбоновые кислоты могут подвергаться дегидратации с образованием циклического внутреннего ангидрида. Необходимо, чтобы атомов углерода в их цепи было не менее четырех (Е.12.76):
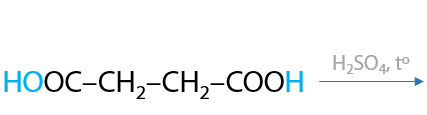
Непредельные карбоновые кислоты сохраняют свойства алкенов и алкинов из-за наличия в углеводородном заместителе либо двойной, либо тройной связей:
Взаимодействие протекает в кислой среде (Г.12.77):

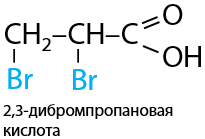
Происходит аналогично присоединению галогенов (Е.12.78). Необходимо проводить присоединение против правила Марковникова, т. к. карбоксильная группа при двойной связи обладает электроноакцепторными свойствами:
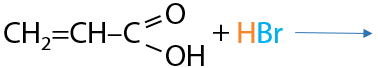
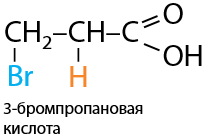
Алкены могут подвергаться полимеризации, которая запускается свободными радикалами в качестве катализаторов. Такие же свойства сохраняют и непредельные кислоты (Е.12.79):
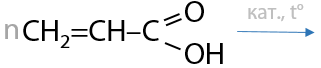
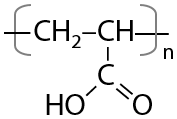
Таким способом получают полиметилакрилат, который используется при производстве художественной пластмассы (Г.12.80):
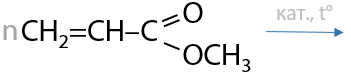

Ароматические карбоновые кислоты сохраняют свойства аренов из-за наличия бензольного фрагмента в строении. Карбоксильная –СООН группа является ориентантом второго рода, что обеспечивает протекание реакций замещения в мета-положение.
Ароматические карбоновые кислоты проявляют более сильные кислотные свойства, чем предельные, из-за стягивания электронной плотность с карбоксильной группы бензольным фрагментом и увеличении полярности связи в гидроксильном фрагменте карбоксильной группы.
Проходит в присутствии кислот Льюиса и по мета-положению относительно карбоксильной группы (Г.12.81):
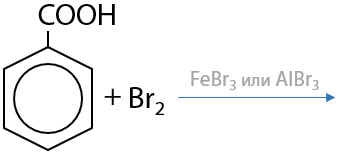

Нитрующая смесь — концентрированные азотная и серная кислоты — обеспечивают введение нитрогруппы в мета-положение относительно карбоксильной группы (Е.12.82):
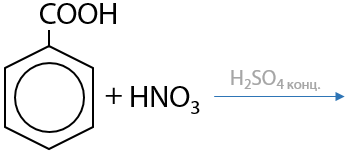
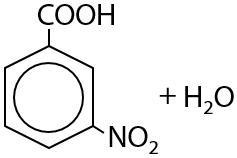
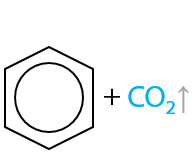
Ароматические карбоновые кислоты при нагревании способны отщеплять углекислый газ и образовывать исходные арены (Г.12.83):

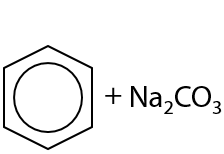
Соли ароматических карбоновых кислот могут вступать в реакцию Дюма: в твердом виде их сплавляют с гидроксидом натрия и в результате образуется исходный арен и карбонат щелочного металла в качестве побочного продукта (Г.12.84).

Вопрос по теме: