Пептиды (с греч. «питательный, перевариваемый») — продукты поликонденсации α-аминокислот, состоящие более чем из двух аминокислотных остатков, содержащие в своем строении пептидную (амидную) связь –CO–NH–, внутри которой наблюдается сопряжение (Е.17.1):
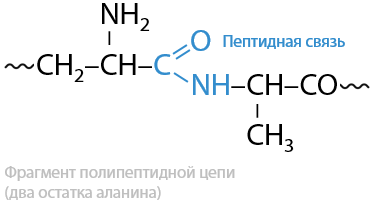
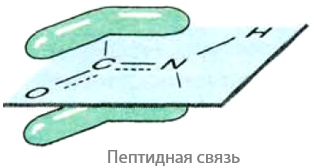
Пептиды можно разделить на три класса:
| Классы пептидов | Характеристика |
| Простые пептиды | Содержат до 10 остатков аминокислот |
| Олигопептиды | Содержат от 10 до 50 остатков аминокислот |
| Полипептиды (белки, протеины) | Содержат более 50 остатков аминокислот |
Белки или протеины (с греч. «первый, важный») — подкласс пептидов, вещества с большой молекулярной массой, состоящие из одной или нескольких полипептидных цепей. При учете одинакового химического строения белки принципиально отличаются от пептидов только длиной цепи и молекулярной массой.
Аминокислоты в общем виде можно представить следующим образом: пусть в дальнейших записях аминогруппа –NH2 будет всегда слева, а карбоксильная группа –СООН справа (Е.17.2):

Все пептиды и белки имеют неразветвленное строение и состоят из двух чередующихся фрагментов — пептидной (амидной) связи –CO–NH– и атома углерода с боковой цепью аминокислоты –CH–R (Е.17.3):
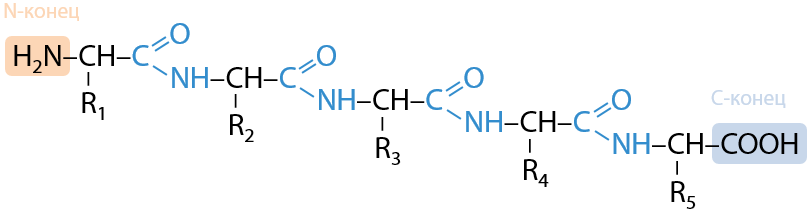
Конец цепи, при котором находится свободная аминогруппа, называется N-конец, а тот, при котором находится свободная карбоксильная группа — C-конец.
Молекулы пептидов несимметричны, а значит свойства пептидов зависят не только от природы используемых аминокислот, но и от того, в каком порядке они связаны между собой. Специфичная последовательность аминокислот определяет первичную структуру пептидов и белков (Г.17.4):
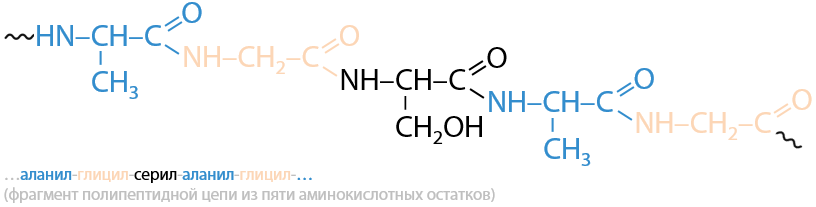
Число аминокислотных остатков (выделены цветом) для различных молекул белком может колебаться от нескольких десятков до нескольких тысяч, а значит они разнятся по молекулярной массе.
Между остатками аминокислот одной цепи возникают водородные связи, которые «сворачивают» первичную структуру в α-спирали или β-слои, а они в дальнейшем «скручиваются» еще сильнее. В каждом витке обычно содержится 3,6 остатка аминокислот. Так происходит переход от первичной структуры ко вторичной и третичной (Г.17.5):
Некоторые пептиды и белки все-таки имеют еще более пространственно сложную четвертичную структуру, которая характеризуется большим числом водородных и ковалентных связей между полипептидными цепями, а также некоторыми другими типами взаимодействия (Г.17.6).
Вопрос по теме: