Для алкенов характерны реакции присоединения по двойной связи с разрывом π-связи. Если же в структуре есть насыщенный углеводородный заместитель (похож на алкан), то возможно проявление химических свойств алканов.
Большая часть реакций алкенов протекает по ионному механизму через стадию образования карбокатиона.
Генетическая связь алкенов и алканов. Реакция имеет равновесный характер, т. к. возможен обратный процесс дегидрирования (см. раздел «Получение алкенов») (Г.2.17):
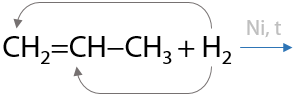
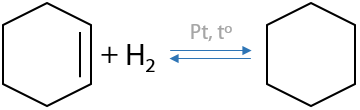
Ионная реакция. Связь между атомами галогенов и π-связь алкена разрываются и в результате взаимодействия образуется дигалогеналканы. Реакция проходит в водной среде, применяются хлорная или бромная вода (Г.2.18):
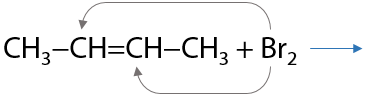
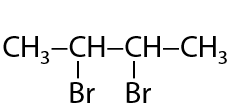
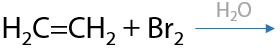

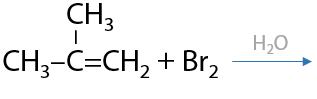
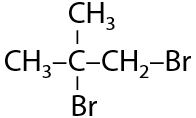
Качественный признак реакции — обесцвечивание бромной воды.
Применение фтора невозможно, т. к. образуются перфторалканы. Иод из-за малой химической активности не присоединяется по двойной связи.
Несимметричные молекулы присоединяются по правилу Марковникова: положительная часть молекулы, обычно, протон H+, присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, т. е. образуется более устойчивый карбокатион.
Ионная реакция. Проводится в водной среде, возможно присоединение только HCl/HBr/HI. Образуются моногалогеналканы. Присоединение HF не происходит в данных условиях (Е.2.19):


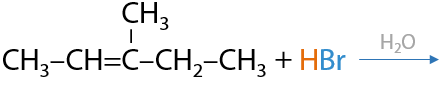
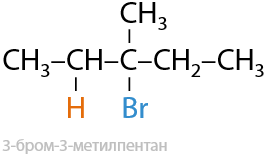
Ионная реакция. Присоединение происходит в кислой среде, применяются серная H2SO4 или фосфорная H3PO4 концентрированные (в редких особых случаях применяют и разбавленные) кислоты. В результате взаимодействия образуются одноатомные спирты (Г.2.20):

![]()


Если рядом с двойной связью находится группа, стягивающая электронную плотность, т. е. в ней есть электроотрицательные атомы (фтор, кислород, хлор), то присоединение несимметричных молекул происходит против правила Марковникова (2.21):
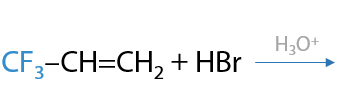
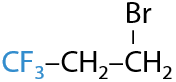
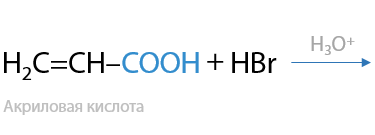
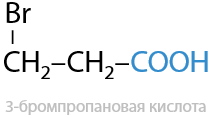
Реакции присоединения, проходящие по радикальному механизму, идут строго против правила Марковникова.
Реакция проводится в присутствии пероксида водорода H2O2 или органических перекисей ROOR. Присоединению подвергается только HBr (Е.2.22):
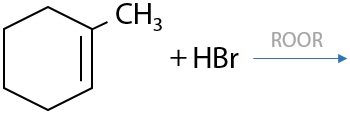
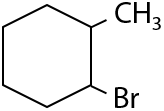
Аллильное положение — атом углерода в sp3-гибридизации, стоящий по соседству с двойной связью. Замещение атомов водорода в этом положении происходит в условиях как у алканов: облучение светом или нагревание до 500 °C (Е.2.23):


Для проведения замещения могут применяться только хлор или бром.
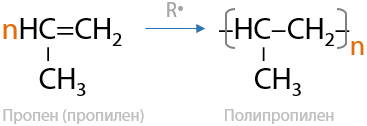
Процесс, при котором происходит разрыв π-связи и соединение мономерных фрагментов между собой с образованием длинной углеродной цепи. Механизм полимеризации может быть как радикальный, так и ионный в зависимости от вещества, инициирующего процесс. По реакции полимеризации получают полиэтилен или полипропилен (Г.2.24):

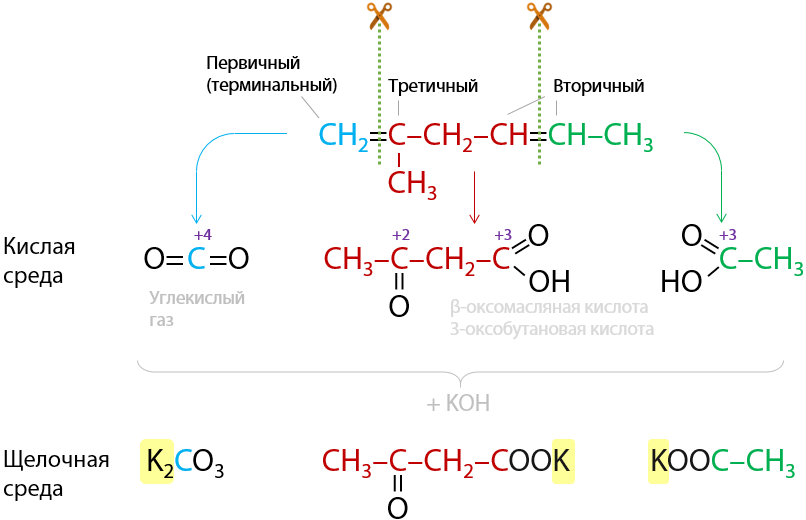
Окисление алкенов происходит по двойной связи: в жестких условиях разрывают и σ-, и π-связи, а в мягких условиях разрывается только π-связь.
Качественная реакция: обесцвечивание раствора перманганата. Происходит разрыв молекулы по двойной связи.
Окисление фрагментов молекулы алкена при двойной связи проходит по следующей схеме (Г.2.25):
Подтвердим схематическое описание реальными уравнениями реакций (Г.2.26):
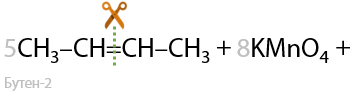
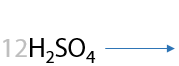


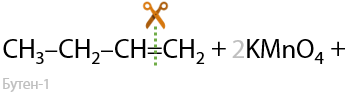


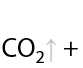

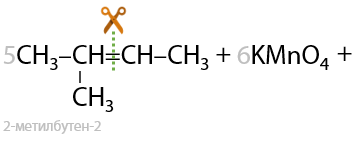
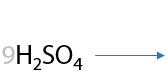

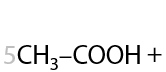
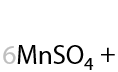

Окисление по Вагнеру. Качественная реакция: обесцвечивание раствора перманганата калия и выпадение бурого осадка MnO2. Окисление проводится при 0 °C. В результате взаимодействия образуются двухатомные спирты (Г.2.27):


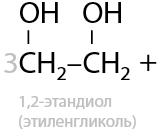

Промышленный способ окисления алкенов с двойной связью при первом атоме углерода до альдегидов. Рассмотрим процесс получения уксусного альдегида. Окисление этилена кислородом воздуха в присутствии катализатора PdCl2 + CuCl2 (Г.2.28):
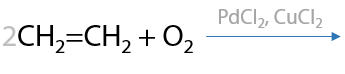

Реакция Прилежаева. Этилен и другие алкены могут взаимодействовать с кислородом воздуха в присутствии серебряного катализатора с образованием эпоксидов — молекул с трехчленными циклами из двух атомов углерода и одного атома кислорода (Г.2.29):
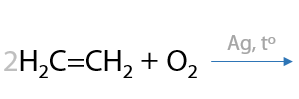

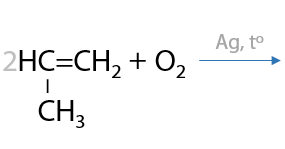
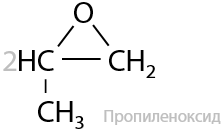
Из эпоксидов в последующем по реакциям полимеризации получают эпоксидные смолы.
Как и другие вещества, состоящие из атомов углерода и водорода, алкены сгорают с образованием углекислого газа и воды (Г.2.30):
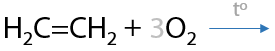
![]()
В общем виде процесс сгорания алкенов можно записать следующим образом (2.31).

![]()
При сгорании алкенов выделяется больше копоти, чем при сгорании алканов, т. к. в алкенах массовая доля углерода выше. Пламя алкенов — красноватое, у алканов — светло-голубое или бесцветное.
Вопрос по теме: