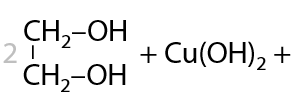В целом, химические свойства многоатомных спиртов напоминают свойства одноатомных спиртов с учетом одного отличия. Наличие нескольких –ОН групп обеспечивает последовательность в протекании химических реакций, а значит можно получать различные моно-, ди-, трипроизводные и т. д.
1) Кислотные свойства
Многоатомные спирты проявляют кислотные свойства сильнее, чем одноатомные спирты, но взаимодействуют со щелочными металлами медленнее из-за высокой вязкости. Поэтому замещение атомов водорода в реакции со щелочными металлами происходит последовательно, при чем первый протон может заместить при комнатной температуре (Г.8.16):
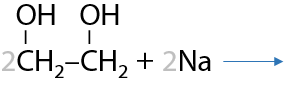
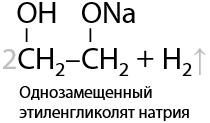
Для замещения второго протона требуется дополнительное нагревание (Е.8.17):
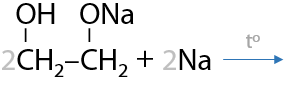
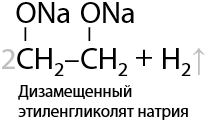
2) Замещение гидроксильной группы на галогены
Замещение –ОН групп происходит также последовательно, как и замещение протонов. В реакции с галогеноводородами (HCl, HBr) замещение проходит по ионному механизму (Е.8.18):
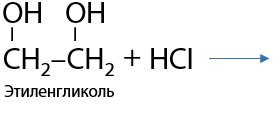
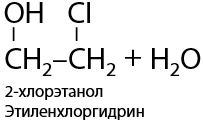
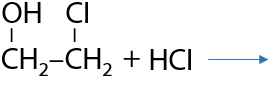
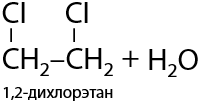
Если на галоген замещена только одна гидроксильная группа, а при соседнем атоме углерода она остается, то при добавлении неорганической щелочи NaOH/KOH возможно дегидрогалогенирование с получением эпоксидов. В данной реакции эпоксид гипотетически можно назвать внутренним циклическим простым эфиром этиленгликоля (Е.8.19):


3) Дегидратация
При высоком нагревании и в присутствии неорганических сильных кислот (H2SO4, H3PO4) происходит внутримолекулярная дегидратация.
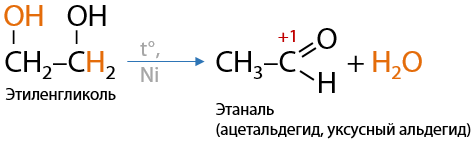
При таком отщеплении молекул воды образуются неустойчивые енольные фрагменты — двойная связь и гидроксильная группа при одном атоме углерода, которые в дальнейшем подвергаются перегруппировке с образованием карбонильных групп.
Таким образом, из этиленгликоля при дегидратации образуется уксусный альдегид (Е.8.20):
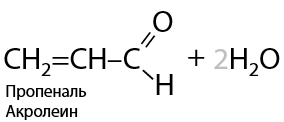
Из глицерина образуется акролеин (Е.8.21):
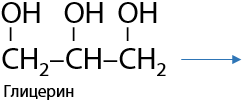
При понижении температуры происходит межмолекулярная дегидратация, при которой возможно получение циклических гетероатомных структур. Например, из этиленгликоля образуется 1,4-диоксан (Г.8.22). Эта реакция встречается в №32 ЕГЭ:


4) Этерификация (взаимодействие с кислотами)
Многоатомные спирты, как и одноатомные, участвуют в образовании сложных эфиров с органическими или неорганическими кислотами (8.23):

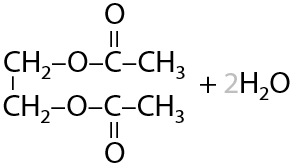
При взаимодействии глицерина с концентрированной азотной кислотой HNO3 образуется тринитроглицерин (нитроглицерин), который относится к классу сложных эфиров (Г.8.24):
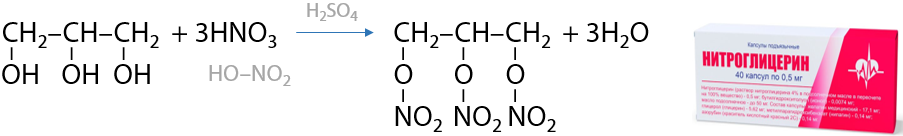
Нитроглицерин — взрывчатое вещество, используемое для изготовления динамита, а также для купирования признаков стенокардии.
При использовании глицерина и высших карбоновых кислоты (кислоты с длинным углеводородным заместителем) могут быть получены жиры (Е.8.25):

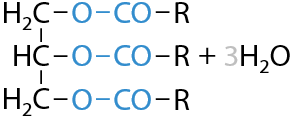
5) Взаимодействие со свежеосажденным Cu(OH)2
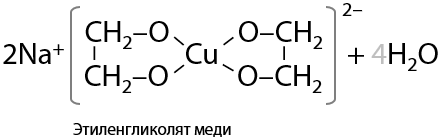
При добавлении к щелочному раствору многоатомного спирта сульфата меди (II) первоначально выпадает гидроксид меди (II), а затем происходит образование комплексного соединения меди, окрашенного в яркий сине-фиолетовый цвет (Г.8.26):
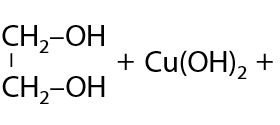
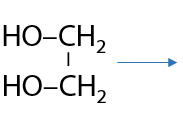

Связи, изображенные стрелками, в структуре комплексного соединения носят донорно-акцепторный характер: неподеленные электронные пары атомов кислорода объединяются с вакантными орбиталями иона Cu2+.
При добавлении избыточного количества щелочи гликолят меди (II) может депротонироваться и образуется комплексная соль (Е.8.27).