Из-за того, что в карбонильной группе происходит перераспределение электронной плотности π-связи и возникают частичные заряды на атомах углерода и кислорода соответственно, то взаимодействие альдегидов с некоторыми другими веществами осуществляется посредством электростатического взаимодействия: «плюс притягивается к минусу, минус притягивается к плюсу» (Е.10.28):
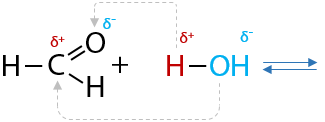
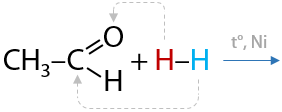
При взаимодействии альдегидов с водородом образуются первичные спирты. Реакция проходит при нагревании и в присутствии металлических катализаторов (Е.10.29):
В более эксклюзивных методах восстановления альдегидов пользуются комплексными гидридами металлов, например боргидридом натрия Na[BH4] или алюмогидридом лития Li[AlH4].
Обратимый процесс. Только для формальдегида и ацетальдегида. Из-за особенностей строения первых двух представителей альдегидов и величины их частичных зарядов в карбонильной группе возможно взаимодействие с водой (Е.10.30)

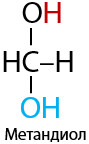
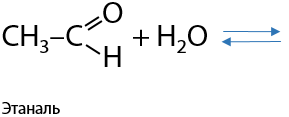

Формальдегид преимущественно существует в форме метандиола (этой формы более 90 % в водном растворе). Равновесие реакции ацетальдегида с водой сильно смещено в сторону реагентов.
При присоединении циановодорода (синильной кислоты) по карбонильной группе образуются вещества, содержащие при одном атоме углерода гидроксильную группу –ОН и цианогруппу –CN. Такие вещества относятся к классу циангидринов (Е.10.31):
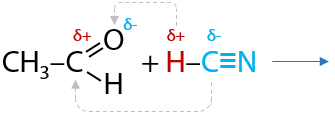

В последствии данная реакция используется для удлинения углеродной цепи на один атом углерода.
Качественная реакция. Альдегиды при взаимодействии с гидросульфитом натрия образуют сульфопроизводные, которые выпадают в форме белого осадка из раствора (Е.10.32):
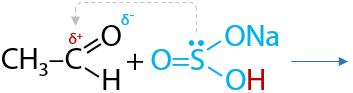
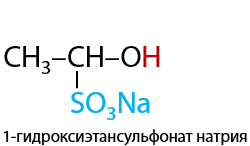
Полученные сульфопроизводные легко разлагаются в кислой среде с получением исходного альдегида (Г.10.33):

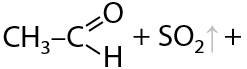

Ранее эти осадки использовали для идентифицирования альдегидов, т. к. сульфопроизводное определенного альдегида имеет конкретную температуру плавления, зная которую можно точно установить структуру исходного карбонильного соединения.
Вещества, образуемые при взаимодействии магния с моногалогеналканами, были открыты Виктором Гриньяром и названы в его честь (Г.10.34):

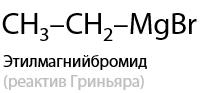
В таких соединениях электронная плотность сильно смещена от атома магния к углероду, за счет чего связь C – Mg легко разрывается. Такое свойство реактивов Гриньяра способствует их присоединению по карбонильной группе альдегидов (Г.10.35):
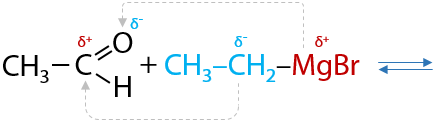

Магнийорганическое производное подвергается гидролизу в кислой среде, в результате чего из альдегидов в две стадии образуются вторичные спирты (Г.10.36):
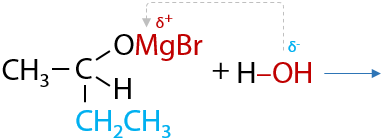
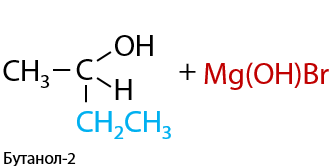
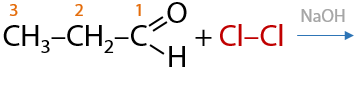
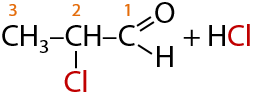
Альдегиды могут взаимодействовать с хлором в щелочном растворе. Замещение атома водорода на атом галогена при этом происходит при α-углеродном атоме, т. к. именно с него карбонильная группа стягивает большее количество электронной плотности, что облегчает протекание замещения (Г.10.37):
С бромом формально происходит аналогичная реакция, только реакция проводится между двумя растворами. Скорость реакции с бромом меньше, чем хлором, из-за его меньшей активности. Качественный признак такой реакции обесцвечивание раствора (Е.10.38):
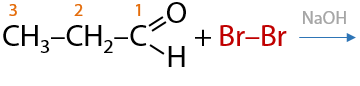
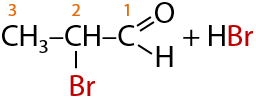
При избытке галогена возможно замещение всех атомов водорода при α-углеродном атоме (Г.10.39):
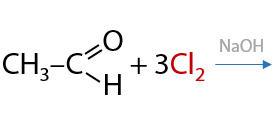

При взаимодействии альдегидов с хлоридом фосфора (V) атом кислорода альдегидной группы замещается на два атома хлора (Е.10.40). Побочный продукт реакции — оксохлорид фосфора (V):

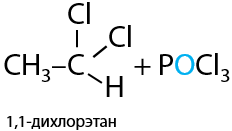
Сложность реакции заключается в подборе растворителя для ее проведения. В водных или щелочных растворах дигалогенпроизводные подвержены гидролизу с образованием исходного альдегида (см. раздел «Получение»)
Качественная реакция. Альдегиды взаимодействуют с аммиачным растворов оксида серебра (реактивом Толленса) с образованием аммонийных солей соответствующих карбоновых кислот, а также с выделением элементарного серебра (Е.10.41):

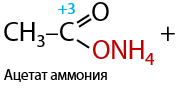




Особая характеристика реакции: при правильном нагревании смеси реагентов (на водяной бане) серебро выпадает на поверхности сосуда в виде серебристой отражающей поверхности, откуда и пошло название реакции. Если нагревать неправильно, то образуется черный хлопьевидный осадок.
Качественная реакция. Аммиачные комплексные соединения меди (II) также окисляют альдегиды до аммонийных солей соответствующих карбоновых кислот (Г.10.42):

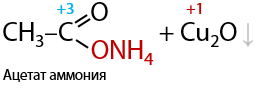
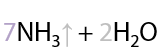
Побочный продукт — кирпично-красный осадок оксида меди Cu2O.
Важно. В ЕГЭ по химии используется более простой вариант написания уравнения реакции, где в качестве реагента изначально записывают гидроксид меди Cu(OH)2 (Е.10.43). Реакцию могут проводить в щелочной или нейтральной среде. В зависимости от этого возможны два продукта: соль или кислота соответственно.
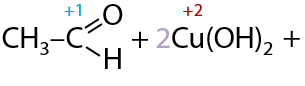
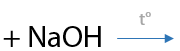
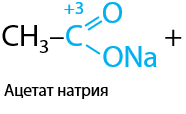
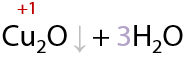
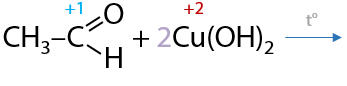
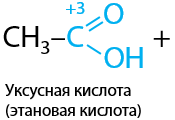

Качественным признаком этой реакции является следующий переход окраски осадка: голубой Cu(OH)2 — желтый CuOH — красный Cu2O.
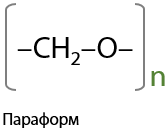
Образующийся полимер называется параформ, он выпадает в осадок в виде белых хлопьев, а затем оседает на дне. Чтобы растворы формальдегида не портились, их стабилизируют добавлением метанола в количестве 0,5-10 % (10.44)

Два альдегида могут взаимодействовать между собой с образованием продукта, имеющего в своем составе гидроксильную группу – ОН и альдегидную группу, т. е. относится к классу альдегидоспиртов, имеющих второе название «альдоли» (Е.10.45):
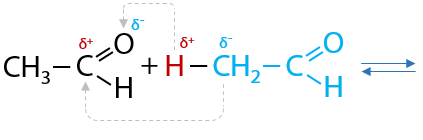
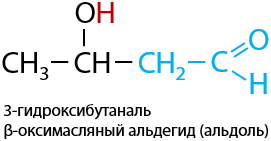
При нагревании от альдолей может происходить отщепление молекулы воды с образованием непредельного альдегида — кротона (Е.10.46):
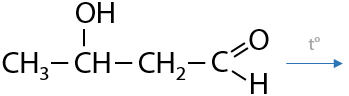

Обычно эти реакции происходят последовательно, поэтому такую конденсацию называют альдольно-кротоновой.
При взаимодействии альдегидов с аминами (или другими соединениями, имеющими –NH2 группу в своем составе) отщепляется молекула воды и образуется двойная связь между атомом углерода альдегидной группы и атомом азота (Р.10.47):

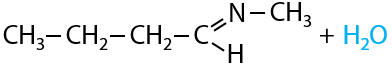
Самый распространенный тип реакций альдегидов, т. к. именно по ней получают большое количество полимерных веществ, используемых в жизни.
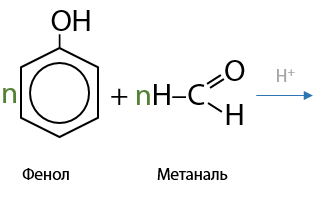
Например, по реакции поликонденсации получают фенолформальдегидные смолы (10.48). Общий примерный механизм взаимодействия фенола с формальдегидом выглядит следующим образом:
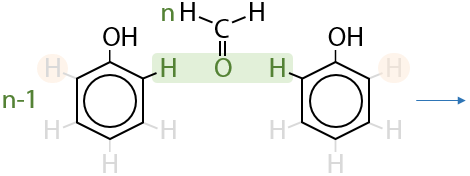
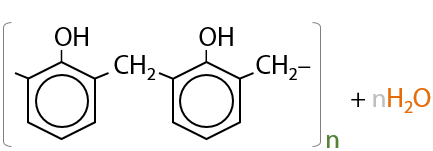
В упрощенном виде реакцию образования фенолформальдегидной смолы можно записать так (10.49):

Вопрос по теме: