Реакции присоединения
Из-за того, что в карбонильной группе происходит перераспределение электронной плотности π-связи и возникают частичные заряды на атомах углерода и кислорода соответственно, то взаимодействие альдегидов с некоторыми другими веществами осуществляется посредством электростатического взаимодействия: «плюс притягивается к минусу, минус притягивается к плюсу» (Е.10.28):
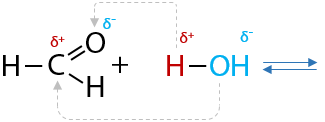
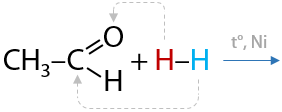
1) Присоединение водорода
При взаимодействии альдегидов с водородом образуются первичные спирты. Реакция проходит при нагревании и в присутствии металлических катализаторов (Е.10.29):
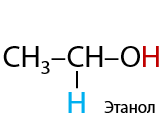
В более эксклюзивных методах восстановления альдегидов пользуются комплексными гидридами металлов, например боргидридом натрия Na[BH4] или алюмогидридом лития Li[AlH4].
2) Присоединение воды
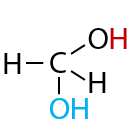
Обратимый процесс. Только для формальдегида и ацетальдегида. Из-за особенностей строения первых двух представителей альдегидов и величины их частичных зарядов в карбонильной группе возможно взаимодействие с водой (Е.10.30)

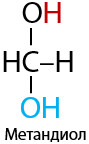
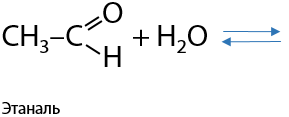

Формальдегид преимущественно существует в форме метандиола (этой формы более 90 % в водном растворе). Равновесие реакции ацетальдегида с водой сильно смещено в сторону реагентов.
3) Присоединение циановодорода HCN
При присоединении циановодорода (синильной кислоты) по карбонильной группе образуются вещества, содержащие при одном атоме углерода гидроксильную группу –ОН и цианогруппу –CN. Такие вещества относятся к классу циангидринов (Е.10.31):
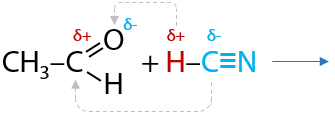

В последствии данная реакция используется для удлинения углеродной цепи на один атом углерода.
4) Присоединение гидросульфита натрия NaHSO3
Качественная реакция. Альдегиды при взаимодействии с гидросульфитом натрия образуют сульфопроизводные, которые выпадают в форме белого осадка из раствора (Е.10.32):
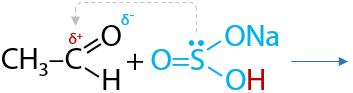
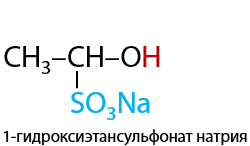
Полученные сульфопроизводные легко разлагаются в кислой среде с получением исходного альдегида (Г.10.33):

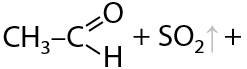

Ранее эти осадки использовали для идентифицирования альдегидов, т. к. сульфопроизводное определенного альдегида имеет конкретную температуру плавления, зная которую можно точно установить структуру исходного карбонильного соединения.
5) Присоединение реактивов Гриньяра
Вещества, образуемые при взаимодействии магния с моногалогеналканами, были открыты Виктором Гриньяром и названы в его честь (Г.10.34):

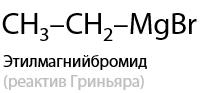
В таких соединениях электронная плотность сильно смещена от атома магния к углероду, за счет чего связь C – Mg легко разрывается. Такое свойство реактивов Гриньяра способствует их присоединению по карбонильной группе альдегидов (Г.10.35):
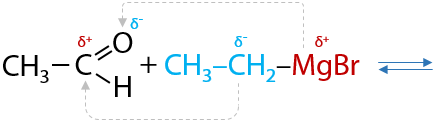

Магнийорганическое производное подвергается гидролизу в кислой среде, в результате чего из альдегидов в две стадии образуются вторичные спирты (Г.10.36):
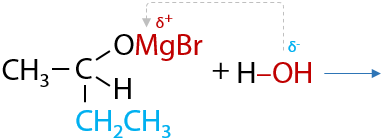
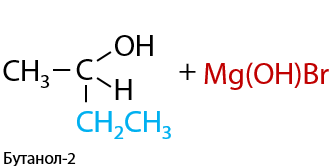
Реакции замещения
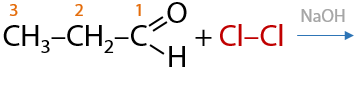
6) Замещение в углеводородном заместителе
Альдегиды могут взаимодействовать с хлором в щелочном растворе. Замещение атома водорода на атом галогена при этом происходит при α-углеродном атоме, т. к. именно с него карбонильная группа стягивает большее количество электронной плотности, что облегчает протекание замещения (Г.10.37):
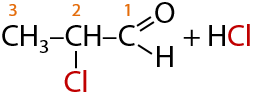
С бромом формально происходит аналогичная реакция, только реакция проводится между двумя растворами. Скорость реакции с бромом меньше, чем хлором, из-за его меньшей активности. Качественный признак такой реакции обесцвечивание раствора (Е.10.38):
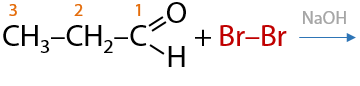
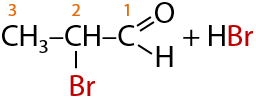
При избытке галогена возможно замещение всех атомов водорода при α-углеродном атоме (Г.10.39):
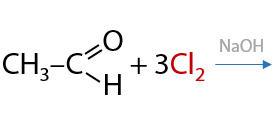

7) Замещение атома кислорода в карбонильной группе
При взаимодействии альдегидов с хлоридом фосфора (V) атом кислорода альдегидной группы замещается на два атома хлора (Е.10.40). Побочный продукт реакции — оксохлорид фосфора (V):

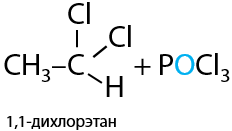
Сложность реакции заключается в подборе растворителя для ее проведения. В водных или щелочных растворах дигалогенпроизводные подвержены гидролизу с образованием исходного альдегида (см. раздел «Получение»)
Реакции окисления
8) Реакция «серебряного зеркала»
Качественная реакция. Альдегиды взаимодействуют с аммиачным растворов оксида серебра (реактивом Толленса) с образованием аммонийных солей соответствующих карбоновых кислот, а также с выделением элементарного серебра (Е.10.41):

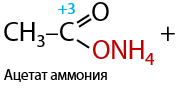




Особая характеристика реакции: при правильном нагревании смеси реагентов (на водяной бане) серебро выпадает на поверхности сосуда в виде серебристой отражающей поверхности, откуда и пошло название реакции. Если нагревать неправильно, то образуется черный хлопьевидный осадок.
9) Окисление комплексными соединениями меди (II)
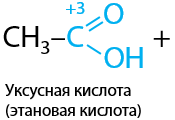
Качественная реакция. Аммиачные комплексные соединения меди (II) также окисляют альдегиды до аммонийных солей соответствующих карбоновых кислот (Г.10.42):

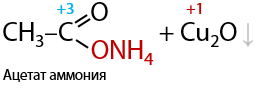
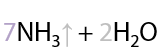
Побочный продукт — кирпично-красный осадок оксида меди Cu2O.
Важно. В ЕГЭ по химии используется более простой вариант написания уравнения реакции, где в качестве реагента изначально записывают гидроксид меди Cu(OH)2 (Е.10.43). Реакцию могут проводить в щелочной или нейтральной среде. В зависимости от этого возможны два продукта: соль или кислота соответственно.
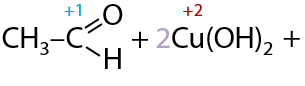
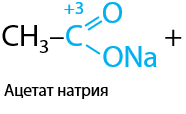
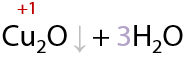
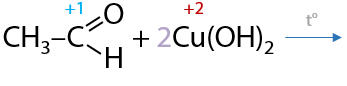

Качественным признаком этой реакции является следующий переход окраски осадка: голубой Cu(OH)2 — желтый CuOH — красный Cu2O.
Реакции полимеризации и конденсации
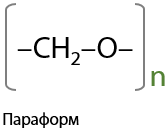
10) Полимеризация формальдегида
Образующийся полимер называется параформ, он выпадает в осадок в виде белых хлопьев, а затем оседает на дне. Чтобы растворы формальдегида не портились, их стабилизируют добавлением метанола в количестве 0,5-10 % (10.44)

11) Альдольно-кротоновая конденсация
Два альдегида могут взаимодействовать между собой с образованием продукта, имеющего в своем составе гидроксильную группу – ОН и альдегидную группу, т. е. относится к классу альдегидоспиртов, имеющих второе название «альдоли» (Е.10.45):
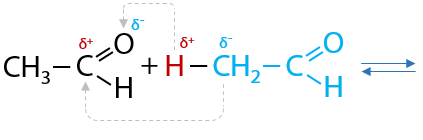
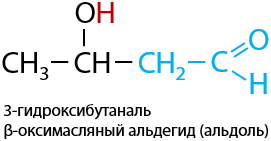
При нагревании от альдолей может происходить отщепление молекулы воды с образованием непредельного альдегида — кротона (Е.10.46):
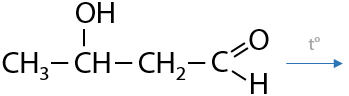

Обычно эти реакции происходят последовательно, поэтому такую конденсацию называют альдольно-кротоновой.
12) Взаимодействие с аминами
При взаимодействии альдегидов с аминами (или другими соединениями, имеющими –NH2 группу в своем составе) отщепляется молекула воды и образуется двойная связь между атомом углерода альдегидной группы и атомом азота (Р.10.47):

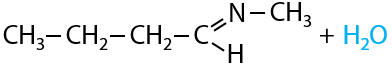
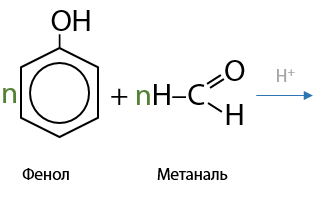
13) Реакция поликонденсации
Самый распространенный тип реакций альдегидов, т. к. именно по ней получают большое количество полимерных веществ, используемых в жизни.
Например, по реакции поликонденсации получают фенолформальдегидные смолы (10.48). Общий примерный механизм взаимодействия фенола с формальдегидом выглядит следующим образом:
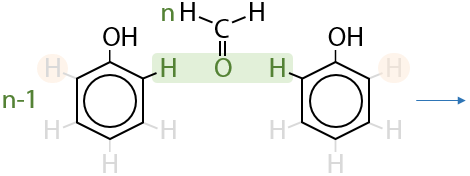
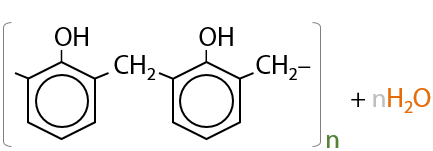
В упрощенном виде реакцию образования фенолформальдегидной смолы можно записать так (10.49):