Амины проявляют основные свойства, но в зависимости от строения с разной силой. Из-за положительного индуктивного эффекта (+I) алкильных заместителей основные свойства аминов выражены лучше, чем у аммиака.
Третичные амины являются более слабыми основаниями, чем первичные и вторичные, из-за пространственных (стерических) затруднений: заместители «закрывают» собой неподеленную электронную пару азота и к ней трудно подобраться.
У ароматических аминов неподеленная электронная пара атома азота вовлечена в общую электронную систему, что обеспечивает более слабые основные свойства даже по сравнению с аммиаком (Г.15.24):
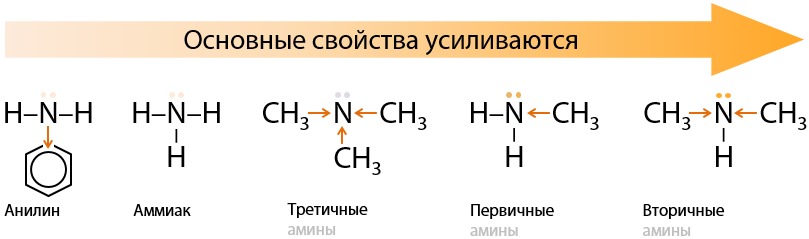
Основные свойства
1) Взаимодействие с водой
Взаимодействие с водой происходит с образованием катионов, похожих на аммоний, образуется новая связь N–Н по донорно-акцепторному механизму (азот — донор электронной пары, протон в молекуле воды — акцептор) (Г.15.25):


Поэтому водные растворы аминов имеют щелочную среду (рН>7).
2) Взаимодействие с кислотами
По аналогии с аммиаком. В результате реакции амина с соляной кислотой образуется соль — в данном случае хлорид метиламмония (Е.15.26):
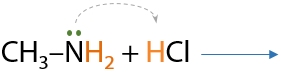
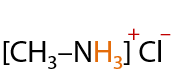
В результате реакции амина с двухосновной серной кислотой также образуется соль — гидросульфат метиламмония. Также может получиться и сульфат метиламмония (средняя соль) для этого необходим избыток амина (Е.15.27):

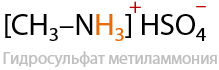


3) Взаимодействие с неорганическими солями
По аналогии с аммиаком можно осаждать нерастворимые гидроксиды за счет повышения основности среды при растворении амина.
Гидроксид алюминия может выпадать в осадок, так как не растворяется в избытке аммиака и амина (15.28):


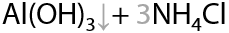

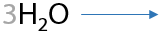

Гидроксид цинка, наоборот, растворяется в избытке аммиака и амина с образованием комплексного соединения (15.29):
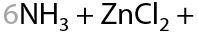


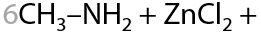


Напомним, что в избытке неорганических щелочей и гидроксид алюминия, и гидроксид цинка растворяются с образованием комплексных соединений (15.30):


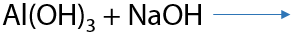

Алкилирование
4) Взаимодействие с галогеналканами
Таким способом из первичных аминов можно получать вторичные, из вторичных — третичные, а из третичных — четвертичные соли аммония (Г.15.31):
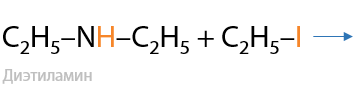


Образование амидов
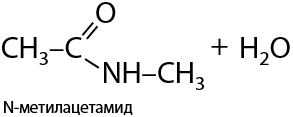
5) Взаимодействие с карбоновыми кислотами
Если карбоксильная группа -СООН и аминогруппа -NH2 находятся в разных молекулах, то образование амида проходит по типу межмолекулярного взаимодействия (Е.15.32):

Если карбоксильная группа и аминогруппа находятся в одной молекуле, но разделены двумя или более атомами углерода, то реакция образования аминов может быть внутримолекулярной (Е.15.33):


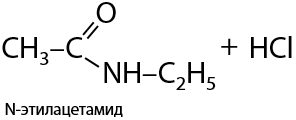
6) Взаимодействие с галогенангидридами карбоновых кислот
Взаимодействие аминов с галогенангидридами также приводит к образованию амидов. Побочный продукт взаимодействия — галогеноводород (Е.15.34):
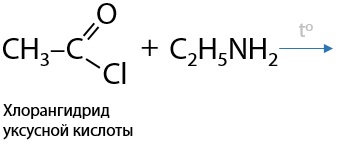
7) Поликонденсация
Вещества с двумя концевыми карбоксильными группами могут вступать в процессы поликонденсации с веществами с двумя концевыми аминогруппами. Например, таким образом получают нейлон-6,6 из адипиновой кислоты и гексаметилендиамина (Р.15.35):

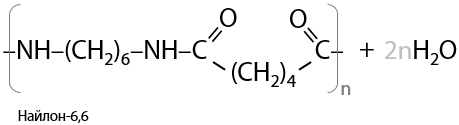
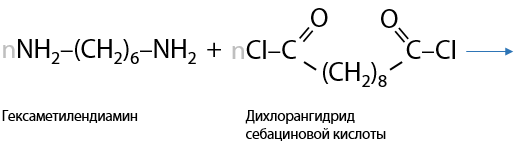
Подобным процессом получают различные пластмассы и волокна. Например, в результате взаимодействия дихлорангидрида декандиовой кислоты с гексаметилендиамином образуется найлон-6,10 более быстро, чем по реакции с карбоновой кислотой (Г.15.36):
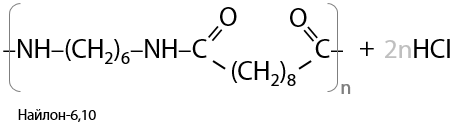
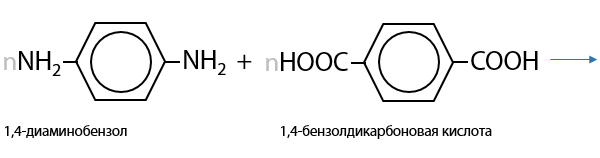
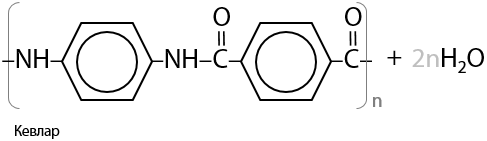
Процесс образования кевлара — огнестойкого, легкого и прочного материала — также подобен прошлым (Г.15.37):
Окисление
8) Взаимодействие с азотистой кислотой
Качественная реакция, позволяющая определить тип амина: выделение бесцветного газа (азота, N2) с первичными аминами.
a. Первичный амин реагирует с HNO2 выделением газообразного азота и образованием спирта (Е.15.38):


b. Вторичный амин реагирует с HNO2 без выделения газа. Запоминаем факт взаимодействия, а не уравнение реакции (Е.15.39):
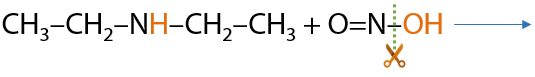

c. Третичный амин не реагирует, так как при атоме азота нет атомов водорода (15.40):
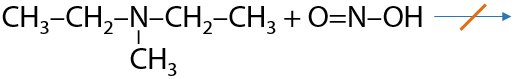
9) Горение
Горение может проходить даже на воздухе. Азотсодержащие углеводороды сгорают до углекислого газа, воды и азота (Р.15.41):
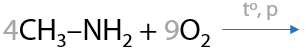
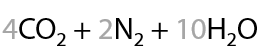
Вспомним, что аммиак тоже сгорает в кислороде и процесс может осуществляться при двух различных условиях: без катализатора или с катализатором (Е.15.42).
