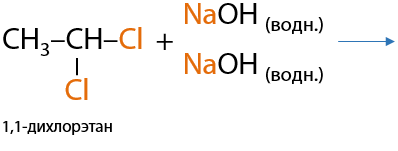1) Окисление спиртов
В зависимости от окислителей может быть и промышленным, и лабораторным способом получения. Чтобы образовался альдегид, гидроксильная группа в молекуле спирта должна находиться при крайнем атоме углерода.
Формальдегид в промышленности получают окислением метанола кислородом воздуха при нагревании в присутствии металлических катализаторов, например, серебра или меди (Е.10.16):

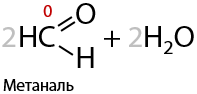
В качестве побочного продукта выделяется вода, которая загрязняет полученные жидкие или газообразные альдегиды из-за их высокой растворимости. Если нагревать первичные спирты в присутствии таких же катализаторов, но без кислорода, то в качестве побочного продукта будет выделяться водород H2. Такой процесс условно можно назвать «дегидрированием спиртов» (Г.10.17):

В лаборатории проблематично проводить окисление с помощью газообразных веществ на твердых катализаторах, поэтому пользуются более простыми вариантами, например дихроматами щелочных металлов в кислой среде (10.18):

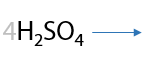
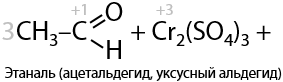
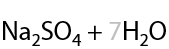
Окисление спиртов можно проводить также при воздействии нагретого оксида меди (II). Такой эксперимент проводят при окислении медной проволоки в пламени горелки, а затем ее погружении в раствор спирта. Качественный признак — возобновление медного розоватого цвета проволоки (10.19):

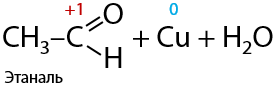
Кроме стандартных окислителей, в лаборатории используют окислительную смесь из оксида хрома (VI) и серной кислоты. Такой метод называется окисление по Джонсу (Г.10.20):
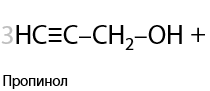
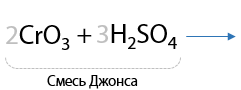
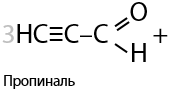
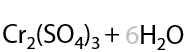
Проблема применения окислителей в том, что реакцию сложно остановить на стадии образования альдегида, т. к. они подвержены образованию карбоновых кислот, являющихся конечным продуктом окисления.
2) Окисление углеводородов
Данный способ — промышленное получение, являющееся более дешевым по сравнению с окислением спиртов.
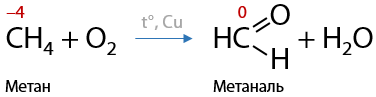
Простейший представитель альдегидов — формальдегид — может быть получен окислением метана кислородом воздуха при нагревании в присутствии металлических катализаторов, например серебра или никеля (Г.10.21):
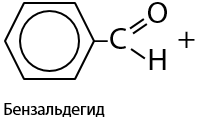
Простейший представитель ароматических альдегидов — бензальдегид — образуется при окислении толуола действием диоксида марганца в кислой среде (Г.10.22):
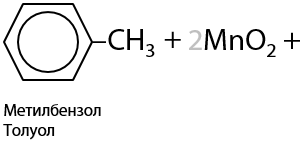

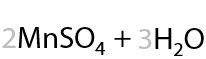
Один из самых распространенных способов получения ацетальдегида в мире — окисление этилена кислородом воздуха на солевом катализаторе из хлоридов палладия (II) и меди (II). Такое окисление называется «Вакер-процесс» (Е.10.23):
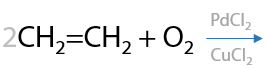

3) Гидратация алкинов — реакция Кучерова
Альдегиды могут быть получены только из ацетилена, другие алкины присоединяют воду с образованием кетонов. Присоединение воды происходит по правилу Марковникова (Г.10.24):
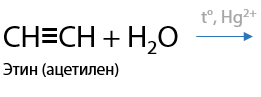

На сегодняшний день этот способ имеет малое распространение, т. к. соли ртути являются ядовитыми не только для человека, но и для флоры и фауны.
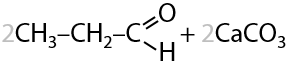
4) Пиролиз карбоновых кислот или их солей
При нагревании смеси формиата кальция и кальцевой соли одноосновной карбоновой кислоты образуются альдегиды. Побочный продукт этой реакции — карбонат кальция (Г.10.25):

Более современным методом получения является нагревание самой карбоновой кислоты с муравьиной кислотой HCOOH в присутствии диоксида титана (Г.10.26):

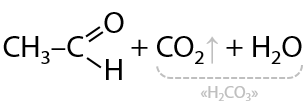
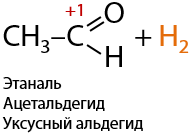
5) Щелочной гидролиз геминальных дигалогеналканов
Если атомы галогенов, в большем количестве случаев хлора, стоят при одном атоме углерода, а он в свою очередь является крайним, то при взаимодействии со щелочью образуются альдегиды (Г.10.27):