Из-за наличия в карбоксильной –СООН группе двух атомов кислорода происходит перераспределение электронной плотности, и молекулы становятся полярными. Между молекулами карбоновых кислот образуются водородные связи (Е.12.18).
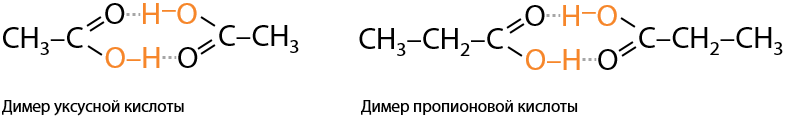
Заметьте, что карбоновые кислоты объединяются попарно в результате образования двух водородных связей между двумя молекулами. Такие димеры очень устойчивы и разрушаются только при сильном разбавлении или высокой температуре.
Прочность водородных связей и большая молекулярная масса каждого соответствующего представителя обеспечивает наличие у карбоновых кислот более высоких температур кипения и плавления по сравнению со спиртами.
Низшие карбоновые кислоты – бесцветные жидкости с резким запахом, хорошо растворимые в воде, а высшие – твердые вещества без запаха, не растворимые в воде.
| Структурная формула |
Температура плавления °C |
Температура кипения °C |
| H–COOH |
8,3 |
100,8 |
| CH3–COOH |
16,8 |
118,1 |
| CH3–CH2–COOH |
−20,8 |
141,1 |
| CH3–CH2–CH2–COOH |
−5 |
163,5 |
| CH3–CH2–CH2–CH2–COOH |
34,5 |
185,4 |