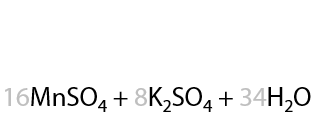Общие способы получения
1) Окисление алканов кислородом воздуха
Раньше муравьиную кислоту получали окислением метана на металлических или оксидных катализаторах (Г.12.19). Такой способ на сегодняшний день утратил распространение из-за низкого выхода муравьиной кислоты и большого количества побочных продуктов:
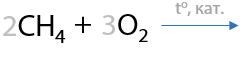

Некоторые алканы, например бутан, при окислении кислородом воздуха на оксидном катализаторе MnO2 претерпевает разрыв примерно по середине и образуется уксусная кислота (Г.12.20):

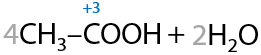
Промышленное значение этот способ имеет для окисления твердых высших алканов, т. к. в результате их окисления образуется смесь высших карбоновых кислот, которые в дальнейшем не разделяют и используют в качестве поверхностно-активных веществ: ПАВ, мыла и многие другие (Г.12.21).
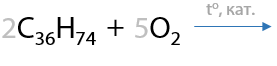

2) Окисление алкенов
Линейные алкены окисляются с разрывом двойной углерод-углеродной связи большинством окислителей, например перманганатом калия KMnO4. При использовании симметричных алкенов образуется единственная карбоновая кислота (Г.12.22):
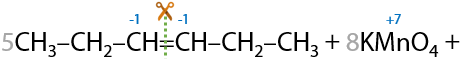
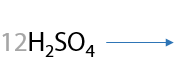

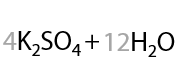
Если двойная связь в алкене находится при крайнем атоме углерода, то помимо карбоновой кислоты образуется углекислый газ в качестве побочного продукта (Г.12.23):
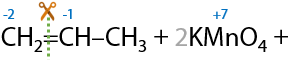



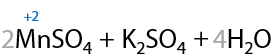
Больше информации в разделе "Окисление алкенов".
3) Окисление первичных спиртов
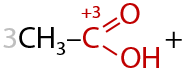
При взаимодействии с окислителями, например кислородом воздуха или перманганатами/дихроматами щелочных металлов при нагревании, первичные спирты в качестве основного продукта реакции образуют карбоновую кислоту (Г.12.24):
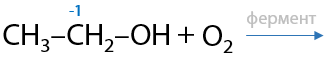
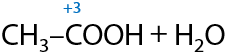
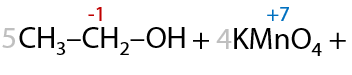
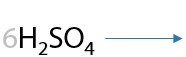
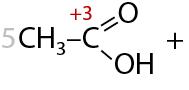


4) Окисление альдегидов
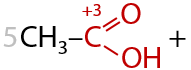
Альдегиды окисляются проще, чем спирты, и теми же окислителями. В результате окисления также образуются карбоновые кислоты в качестве основного продукта (Г.12.25):
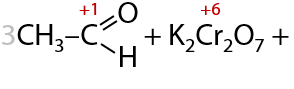
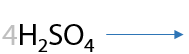
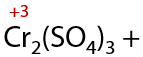
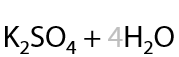

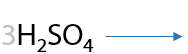

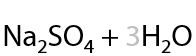
5) Взаимодействие реактивов Гриньяра с углекислым газом
Вещества, образуемые при взаимодействии магния с моногалогеналканами, были открыты Виктором Гриньяром и названы в его честь (Е.12.26):
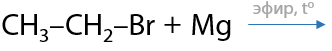

В таких соединениях электронная плотность сильно смещена от атома магния к углероду, за счет чего связь C–Mg легко разрывается. Такое свойство реактивов Гриньяра способствует их присоединению по карбонильной группе, даже если она находится в составе углекислого газа (Е.12.27). При дальнейшем гидролизе магнийорганического производного в водной среде образуется карбоновая кислота:

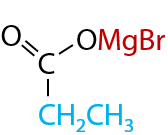
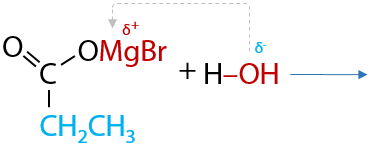
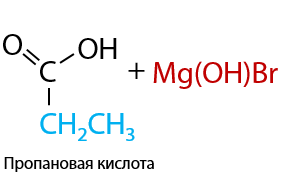
Реакции гидролиза
6) Гидролиз солей карбоновых кислот
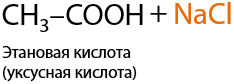
При использовании неорганических кислот, которые являются более сильными, чем карбоновые, происходит вытеснение вторых из их солей соответственно (Е.12.28):


7) Гидролиз геминальных тригалогеналканов
При взаимодействии тригалогеналканов, у которых все атомы галогена находятся при крайнем атоме углерода, с щелочами происходит замещение атомов галогенов на гидроксильные группы с "одновременной дегидратацией" и образованием карбоновой кислоты (Е.12.29). В щелочной среде образуется соответствующая соль, из-за чего на финальной стадии происходит подкисление реакционной среды:


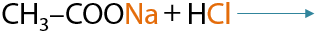
8) Гидролиз сложных эфиров или жиров
Обратимая реакция. При кислотном гидролизе сложных эфиров в водной среде происходит образование карбоновой кислоты и спирта в качестве побочного продукта (Е.12.30). Жиры, как подкласс сложных эфиров, также могут подвергаться гидролизу с образованием высших карбоновых кислот и глицерина:
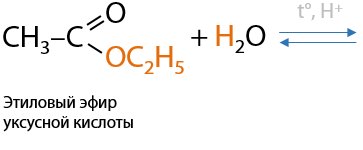

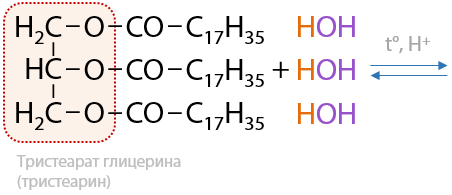
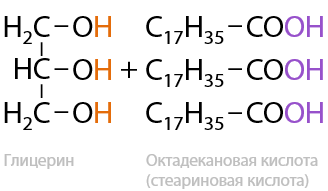
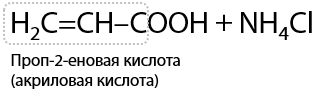
9) Гидролиз нитрилов R–CN
Нитрилы — производные карбоновых кислот, в которых есть функциональный фрагмент –CN. Нитрильная группа в кислой среде подвергается гидролизу по тройной углерод-азотной связи, что приводит к образованию карбоновой кислоты и, например, хлорида аммония в качестве побочного продукта (Г.12.31):
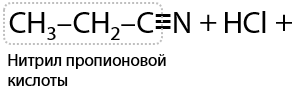
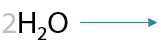
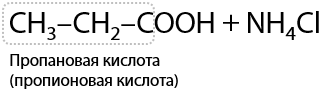
Получение муравьиной кислоты
10) Щелочной метод
Монооксид углерода (угарный газ) при высоком давлении и температуре взаимодействует с гидроксидом натрия и образуется формиат натрия (натриевая соль муравьиной кислоты). При подкислении неорганической кислотой высвобождается метановая или муравьиная кислота (Е.12.32):
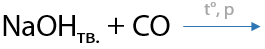

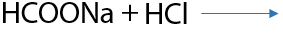

Получение уксусной кислоты
11) Карбонилирование метанола
Большую часть всей уксусной кислоты на сегодняшний день получают взаимодействием монооксида углерода с метанолом в присутствии гомогенных катализаторов на основе платиновых металлов, что по сути является введением карбонильной группы в молекулу спирта (Е.12.33):


В данном процессе уксусная кислота загрязнена остатками метанола (ядовит для человека), а значит не может применяться для пищевой промышленности.
12) Уксуснокислое брожение этанола
Биотехнологический способ. Некоторые ферменты (белки) могут превращать этанол в уксусную кислоту. В качестве сырья используют соки фруктов, которые подготовительно сбраживают добавлением небольших количеств этанола, а суммарный процесс выглядит следующим образом (Г.12.34):
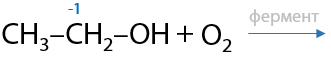
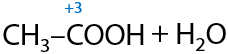
Получение пропионовой кислоты
13) Гидрокарбонилирование этилена
В структуру этилена на некоторых катализаторах можно ввести карбонильную и гидроксильную группу одновременно, что суммарно обеспечивает получение пропионовой кислоты (Г.12.35):
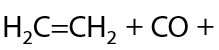

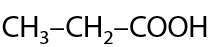
14) Карбонилирование этанола
Получение аналогично уксусной кислоте, для получения пропионовой кислоты необходимо взять спирт на один атом углерода длиннее (Г.12.36):

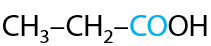
Получение непредельных карбоновых кислот
15) Получение акриловой кислоты из пропена
Акриловая кислота — простейший представитель непредельных кислот. В промышленности ее получают окислением пропена кислородом воздуха на катализаторе MoO3 (Е.12.37):
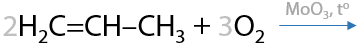

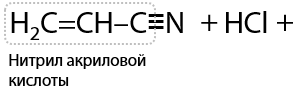
16) Получение акриловой кислоты из нитрила
Кислотный гидролиз нитрила акриловой кислоты приводит к ее высвобождению и образованию хлорида аммония в качестве побочного продукта (Г.12.38):

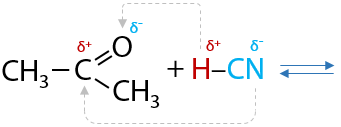
17) Получение метакриловой кислоты из ацетона — циангидринный синтез
Ацетон или пропанон относится к классу карбонильных соединений, которые могут присоединять по карбонильной группе синильную кислоту (Г.12.39):
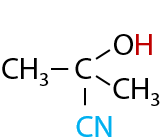
Образующееся вещество содержит при одном атоме углерода и гидроксильную группу –ОН, и цианогруппу –CN, из-за чего оно и относится к классу циангидринов. Цианогруппа подвергается гидролизу в кислой среде с высвобождением карбоновой кислоты — в данном случае 2-гидрокси-2-метилпропановой кислоты (Г.12.40):

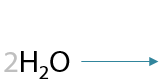
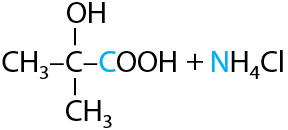
При ее нагревании в кислой среде происходит дегидратация с образованием двойной связи, что приводит к образованию 2-метилпроп-2-еновой или метакриловой кислоты (Г.12.41):
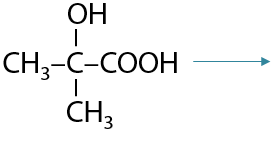
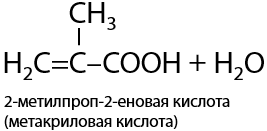
Получение ароматических карбоновых кислот
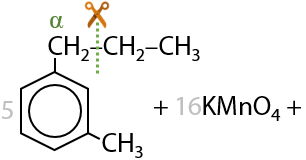
18) Окисление гомологов бензола
При окислении гомологов бензола алкильные заместители превращаются в карбоксильный группы и некоторые побочные вещества (см. «Химические свойства аренов»). Данный факт используется для получения моно-, ди- и поликарбоновых кислот.
Бензойная кислота — простейший представитель ароматических карбоновых кислот — может быть получена при окислении толуола стандартными окислителями при нагревании (Г.12.42):
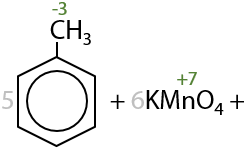
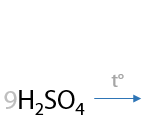
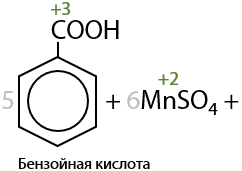

При окислении дизамещенных аренов будут образовывать дикарбоновые ароматические кислоты (Г.12.43).