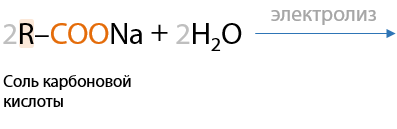1) Несинтетический метод
Метан и другие газообразные алканы в большом количестве содержатся в попутном, нефтяном, болотном и рудничном газовых смесях. При перегнивании растений и животных остатков также выделяются газообразные алканы — метан даже имеет тривиальное название «болотный газ».
2) Прямое взаимодействие углерода и водорода
Таким способом получают метан при обработке отходов каменного угля. Необходимы высокая температура или электрический разряд (Г.1.7):

Параллельно с метаном в данном процессе могут образовываться и другие алканы. Полученную смесь необходимо разделять для выделения индивидуальных алканов.
3) Образование алканов из «синтез-газа»
Синтез Фишера-Тропша. При взаимодействии угарного газа СО и водорода (смесь называется «синтез-газ») образуется смесь алканов различного строения и длины. Такая смесь алканов называется «синтетический бензин». Необходимые условия: металлический катализатор (Ni, Со, или Fe) и повышенная температура (Е.1.8):



В общем виде синтез Фишера-Тропша можно записать следующим образом (Е.1.9):

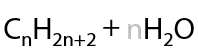
4) Гидролиз карбидов
Al4C3 относится к классу карбидов — метаниды, т. е. атом углерода имеет степень окисления −4 и при его гидролизе в водной среде выделяется метан (Г.1.10):


К метанидам еще относятся карбиды бериллия Be2C и магния Mg2C, которые также подвергаются гидролизу с получением метана (1.11):

5) Гидрирование непредельных углеводородов
Кратные связи — двойная и тройная — способны присоединять молекулы водорода. Гидрирование происходит на поверхности металлических катализаторов — Pt, Pd или Ni (Г.1.12):


На самом деле непредельные углеводороды намного более ценное сырье для промышленности, поэтому чаще используют обратный процесс дегидрирования алканов.
6) Реакция Вюрца
Реакция удвоения углеводородного радикала галогеналкана при взаимодействии с натрием, разработанная Ш. Вюрцем в 1855 году. Для проведения реакции можно использовать любые галогеналканы, кроме фторпроизводных. Реакция имеет малый выход, поэтому не используется в органических синтезах (Е.1.13):


Заметьте, что образуется алкан симметричного строения.
7) Декарбоксилирование солей карбоновых кислот
Реакция Дюма. При нагревании твердых соли карбоновой кислоты и соответствующей щелочи происходит отщепление карбоната щелочного металла и образуется алкан. Количество атомов углерода в алкане на один меньше, чем в исходной соли — один атом углерода затрачивается на образование карбоната (Е.1.14):

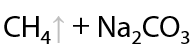
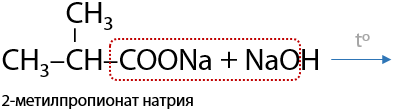

8) Электролиз солей карбоновых кислот
Электролиз по Кольбе. Удвоение углеводородного радикала при карбоксильной группе, образование симметричных алканов.
На катоде выделяется водород, на аноде — алкан и углекислый газ. Щелочь образуется около катода (Е.1.15):
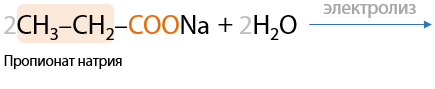
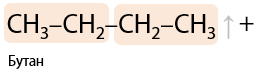

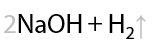
В общем виде электролиз солей карбоновых кислот можно записать следующим образом (1.16).