Получение ацетилена
1) Пиролиз метана
Промышленный способ, метан выделяют из природной, попутной или рудничной газовых смесей (Е.3.9):

Таким способом в 1862 году М. Бертло получил ацетилен, пропуская через трубку, наполненную метаном, электрический разряд.
Основная проблема пиролиза в том, что при долгом нагревании конечными продуктами реакции являются углерод (сажа) и водород. Чтобы предотвратить полное разложение, ацетилен необходимо быстро выводить из зоны нагревания.
2) Окислительный пиролиз метана
Чтобы избежать разложения, пиролиз ведут в присутствии кислорода. Количество кислорода строго рассчитывается для исключения конечного горения (Г.3.10):
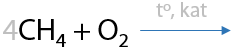
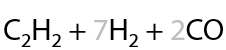
Заметьте, что в результате реакции образуется еще и смесь монооксида углерода и водорода — «синтез-газ». Его можно использовать для получения синтетического бензина или спиртов.
3) Гидролиз карбида кальция
Один из самых распространенных лабораторных методов (Е.3.11). Впервые таким способом воспользовался Ф. Велер в 1862 году:


Любые карбиды-ацетилениды в результате водного или кислотного гидролиза будут образовывать ацетилен в качестве целевого продукта (Г.3.12):

Получение гомологов ацетилена
4) Дегидрогалогенирование дигалогеналканов
Похоже на реакцию дегидрогалогенирования для получения алкенов, только в двукратном размере (см. раздел «Получение алкенов»). Впервые в XIX веке русские ученые — М. М. Мясников и В. И. Савич — получили ацетилен таким способом (Г.3.13):
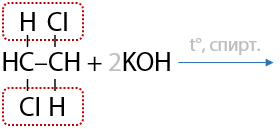
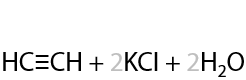
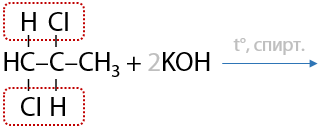
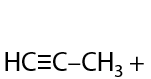

Данный способ имеет больше теоретический интерес, т. к. на практике для отщепления второй молекулы галогеноводорода требуется более сильное основание по сравнению с неорганической щелочью. Например, можно применять амиды щелочных металлов MNH2 (Г.3.14):
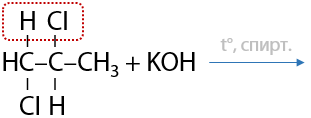
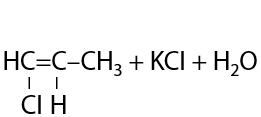
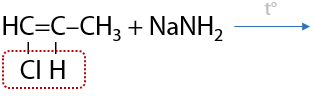
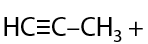
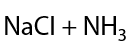
5) Взаимодействие алкинидов с галогеналканами
Лабораторный способ удлинения цепи алкина. В первую очередь необходимо образовать алкинид из терминального алкина взаимодействием с амидом щелочного металла (Г.3.15):


Далее добавляют галогеналкан, и в результате их взаимодействия отщепляется неорганическая соль. Образуемый алкин имеет более длинный углеродный скелет по сравнению с начальным, а тройная связь смещается ближе к середине молекулы (Е.3.16).

