Алкины являются непредельными углеводородами, значит в первую очередь их свойства связаны с наличием кратной (тройной) связи в составе молекулы. Основной тип реакций алкинов — присоединение, что аналогично свойствам алкенов (см. раздел «Химические свойства алкенов»).
Алкины, содержащие тройную связь при начальном атоме углерода, проявляют кислотные свойства, т. е. могут вступать в реакции с веществами, обладающими основным характером. Данное свойство используется для удлинения углеродного скелета алкинов и получения гомологов ацетилена.
По сравнению с алкенами реакции с алкинами идут медленнее и труднее, т. к. длина тройной связи меньше, чем двойной, а также ее поляризуемость меньше: тройную связь труднее «разрывать», чем двойную.
Реакции присоединения
Реакции присоединения могут протекать в две стадии с последовательным разрывом двух π-связей.
1) Гидрирование
Алкины последовательно превращаются в алкены и затем в алканы при присоединении водорода. На практике реакция идет сразу до образования алканов (Г.3.17):


Катализаторами в реакциях гидрирования являются переходные металлы: никель, платина или палладий.
2) Галогенирование
Качественная реакция: обесцвечивание бромной воды (Г.3.18):
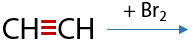

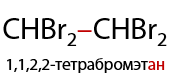
Суммарная реакция присоединения избыточного количества галогена (Г.3.19):

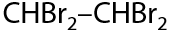
3) Гидрогалогенирование
Катализатор — разбавленная кислота H+, обычно серная H2SO4, или хлорид алюминия AlCl3. Присоединение одной молекулы галогеноводорода происходит по правилу Марковникова (Е.3.20):
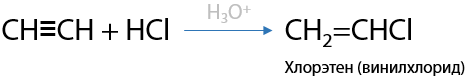
Винилхлорид используется для производства поливинилхлорида — ПВХ (Г.3.21):
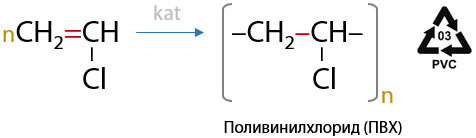
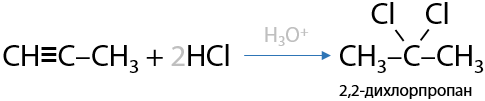
При избытке HCl присоединение происходит по обеим π-связям, при чем в процессе присоединения каждой молекулы необходимо пользоваться правилом Марковникова (Е.3.22):
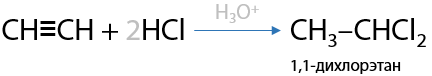
4) Гидратация
Реакция Кучерова. Катализатор соли ртути (II), а точнее, катионы ртути Hg2+, в кислой среде H+. Присоединение идет по правилу Марковникова. При гидратации ацетилена получается альдегид (Г.3.23):

Данные реакции исследовал русский химик-органик А. П. Эльтеков. В 1877 году он доказал, что нельзя получить гидроксильную группу при двойной связи, она обязательно вступает в перегруппировку и образуются карбонильные соединения (Г.3.24):
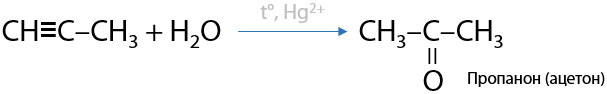
Сущетсвует правило Эльтекова, которое гласит: «Спирты, содержащие гидроксильную группу у атома углерода с двойной связью, неустойчивы и изомеризуются в альдегиды или кетоны». На основе данного правила можно привести условный механизм присоединения воды к различным алкинам (Г.3.25):
Полимеризация
5) Димеризация
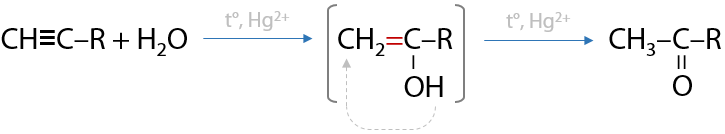
Катализаторы CuCl, NH4Cl. В процессе димеризации образуется винилацетилен, который в дальнейшем используется для получения каучуков (Г.3.26):

Гидрохлорирование винилацетилена происходит по тройной связи с образованием хлоропрена, который может полимеризоваться с образованием хлоропренового каучука (Г.3.27):

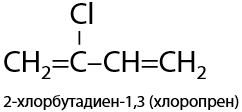
6) Тримеризация
Реакция открытая М. Бертло в 1866 году. При нагревании ацетилена ему удалось получить небольшое количество бензола. Спустя еще 60 лет, русский химик Н. Д. Зелинский обнаружил, что повысить выход бензола можно использованием катализатора из активированного березового угля (Г.3.28):

При использовании пропина в процессе тримеризации образуется мезитилен — 1,3,5-триметилбензол (3.29):
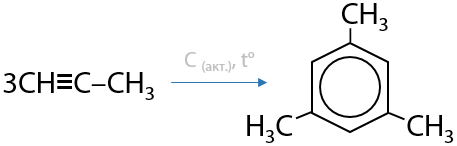
На сегодняшний день процессы тримеризации имеют только теоретический интерес, в промышленности таким образом получать арены (ароматические соединения) слишком затратно.
7) Получение полиацетилена
Ацетилен в присутствии катализаторов Циглера-Натта может образовать полиацетилен. Этот полимер существует в виде двух изомеров — цис- и транс-, при чем их свойства тоже различны (Г.3.30):
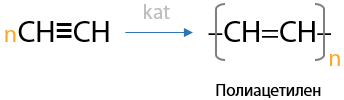
Полиацетилен родоначальник токопроводящих полимеров, которые не нашли применения, но при этом обладают интересными свойствами, например, при покрытии их иодом получаются золотистые материалы, которые еще лучше проводят электрический ток.
8) Присоединение спиртов
В 1888 году русский химик-органик А. Е. Фаворский обнаружил, что алкины могут присоединять спирты (Г.3.31):


Образующийся в этой реакции этилвиниловый эфир имеет в структуре двойную связь, а значит вступает в процессы полимеризации как алкены (Г.3.32):
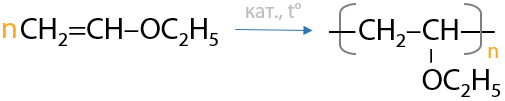
9) Присоединение карбоновых кислот
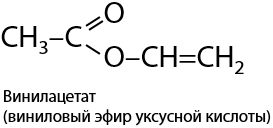
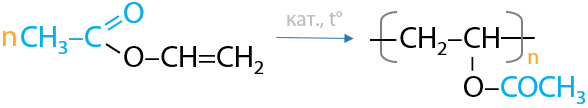
В 1912 году немецкий химик Ф. Клатте обнаружил, что алкины способны присоединять карбоновые кислоты с образованием сложных непредельных эфиров (Г.3.33):

Интересно то, что такие непредельные эфиры способны полимеризоваться с образованием полимерных предельных сложных эфиров (Г.3.34):
В процессе гидролиза сложноэфирной группы можно получить поливиниловый спирт (да, он неустойчивый в индивидуальном виде, но в полимерной форме получен), который используется для создания биоразлагаемых оболочек для лекарственных средств (Г.3.35):
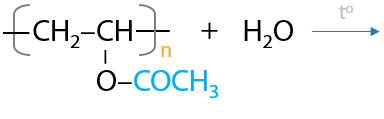
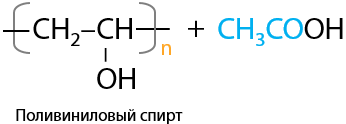
Реакции замещения (кислотные свойства)
Алкины с концевой тройной связью (терминальные) проявляют СН-кислотность, т. е. способны вступать в реакции замещения кислотного концевого протона. Продукты замещения в общем случае называются алкиниды, в случае ацетилена — ацетилениды.
СН-кислотность алкинов объясняется высокой электроотрицательностью sp-гибридного атома углерода при тройной связи, из-за чего возможен гетеролитический разрыв С–Н связи. Электроотрицательность sp2- и sp3-гибридных атомов углерода в алкенах и алканах меньше, поэтому они не обладают похожим свойством.
10) Образование ацетиленидов серебра и меди
Качественная реакция (Г.3.36): серый осадок ацетиленида серебра и кирпично-красный осадок ацетиленида меди (I).



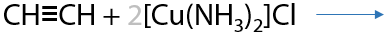

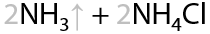
Ацетилениды тяжелых металлов взрывоопасные и могут детонировать при ударе или сотрясении.
11) Образование алкинидов щелочных металлов
Взаимодействие терминальных алкинов с натрием и калием или их амидами MNH2 в жидком аммиаке (Г.3.37):


Окисление
12) Мягкое окисление
В процессе взаимодействия алкинов с окислителями первоначально происходит «разрыв» π-связей. Мягкое окисление нейтральным (слабощелочным) раствором перманганата калия KMnO4. Качественная реакция на кратные связи — двойные и тройные — с образованием осадка диоксида марганца (Г.3.38):


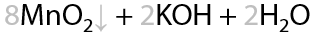
13) Жесткое окисление
Раствором KMnO4 в кислой среде. Способ определения положения кратной связи в алкине по продуктам окисления. Качественная реакция на кратные связи: обесцвечивание фиолетового раствора перманганата калия (Е.3.39):
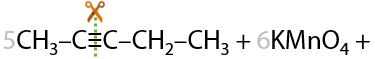
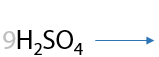
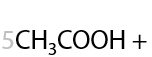
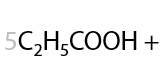
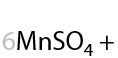
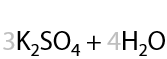
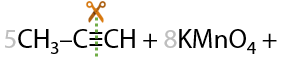
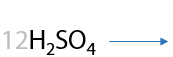

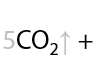

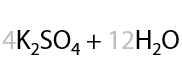
Определение положения кратной связи: если в процессе окисления выделился газ (углекислый CО2), то тройная связь находилась при крайнем атоме углерода.
14) Горение
Типичная реакция для любых углеводородов — все сгорают до углекислого газа и воды. Выделение большого количества копоти по сравнению с алканами и алкенами: чем выше массовая доля углерода в соединении, тем больше копоти при горении (Г.3.40).

Ацетилен горит бледно-голубым пламенем. Экзотермичность реакции настолько высока, что температура при горении достигает 3100 °C, что позволяет использовать ее для сварки.