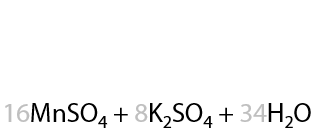1) Гидрирование
Присоединение водорода ароматической системой происходит в чрезвычайно жестких условиях — высокая температура, высокое давление и металлические катализаторы (Е.6.17):
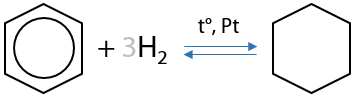

2) Галогенирование
Реакция может проводиться по ионному (в присутствии солей железа (III) или алюминия) или радикальному (при облучении светом) механизмам (Е.6.18).
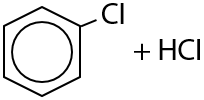
Галогенирование аренов возможно только хлором CI2 или бромом Br2. В присутствии кислот Льюиса (соли железа (III) или алюминия) происходит замещение атома водорода в бензольном кольце на атом галогена. Побочный продукт — галогеноводород:
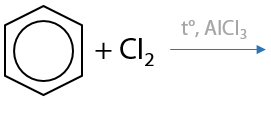
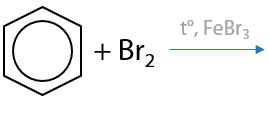
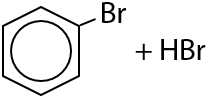
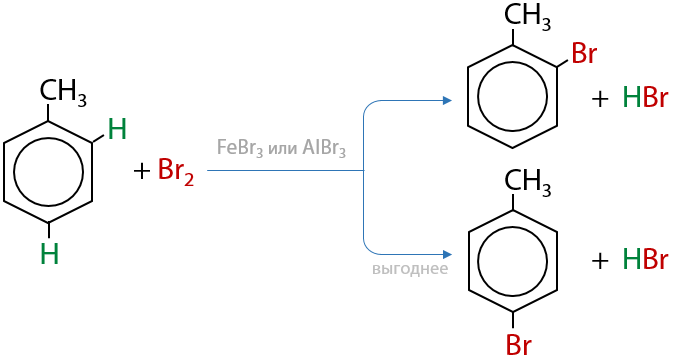
При галогенировании гомологов бензола в присутствии кислот Льюиса может происходит замещение либо в орто-положении относительно углеводородного заместителя, либо в пара-положении. Чтобы углеводородный заместитель и атом галогена «не находились слишком близко и не толкались», более выгодным считается пара-положение (Е.6.19):
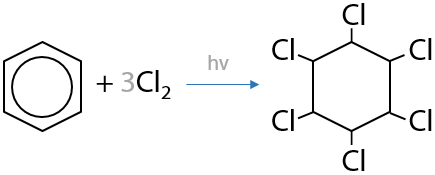
Галогенирование бензола и его гомологов также возможно и на свету. При галогенировании бензола данным методом происходит присоединение трех молекул галогена с образованием насыщенного шестичленного цикла (Е.6.20):
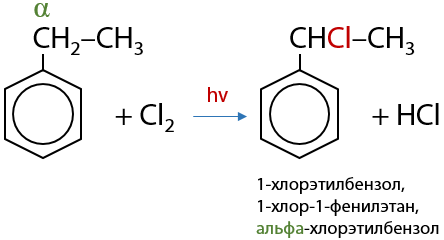
При галогенировании гомологов бензола на свету замещение атомов водорода будет происходит в алкильном заместителе, при чем при ближайшем к кольцу атоме углерода — бензильное или α-положение (Е.6.21):
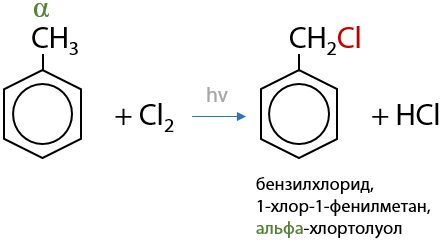
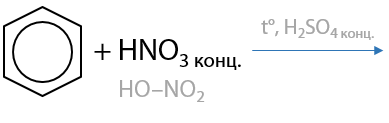
3) Нитрование
Проводится при нагревании нитрующей смесью — концентрированные азотная и серная кислоты. Серная кислота выступает в роли катализатора, а азотная кислота — реагент. Побочный продукт реакции — вода (Е.6.22):

При дальнейшем проведении нитрования вторая нитрогруппа –NO2 вводится при более высокой температуре в мета-положение (Е.6.23):
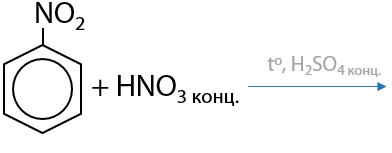
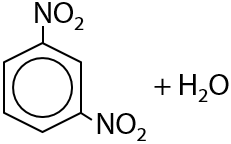
При нитровании гомологов бензола нитрогруппы будут вводится в ароматическое кольцо последовательно: сначала в пара-положение, затем в орто-положение. Чем больше нитрогрупп уже находится в кольце, тем медленнее протекает последующее нитрование.
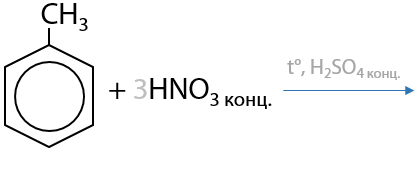
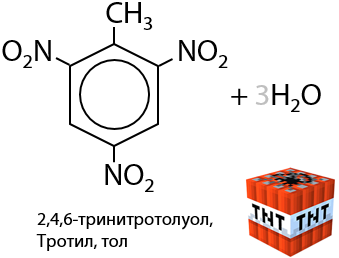
Из толуола посредством нитрования можно получить тринитротолуол — ТНТ — взрывчатое вещество (Г.6.24):
4) Сульфирование
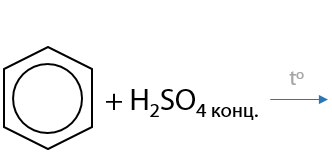
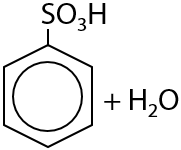
Взаимодействие аренов с концентрированной серной кислотой. Результат реакции — введение сульфогруппы –SO3H (Г.6.25). Побочный продукт реакции — вода:
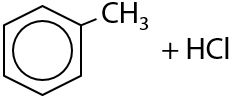
5) Введение алкильного заместителя
Реакция Фриделя-Крафтса. Процесс используется для получения гомологов бензола. Взаимодействие галогеналканов и аренов проходит только в присутствии солей железа (III) или алюминия (6.26):
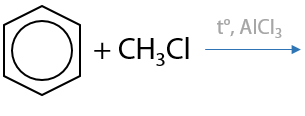
6) Окисление
При полном окислении арены, как и другие углеводороды, сгорают до образования углекислого газа и воды (Г.6.27):


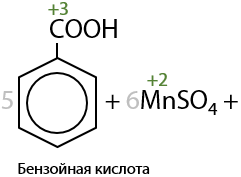
Сам бензол не окисляется стандартными окислителями — не обесцвечивает перманганаты или дихроматы. А гомологи бензола при неполном окислении превращаются в бензойную кислоту C6H5–COOH.
Отличие их окисления в том, что углеводородный радикал может превращаться в различные продукты в зависимости от количества углеродов в нем.
Если окисляется толуол, то в данном случае будет только один углеродсодержащий продукт — бензойная кислота (Г.6.28):

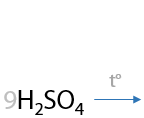
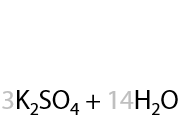
При окислении этилбензола происходит разрыв С–С связи в углеводородном заместителе и образование бензойной кислоты и углекислого газа (Е.6.29):

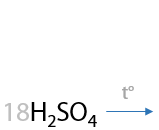


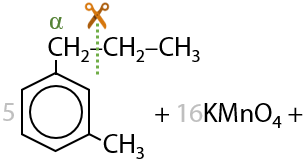
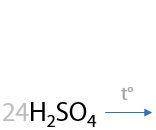
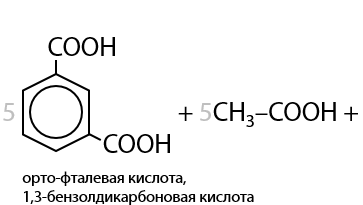
При окислении пропилбензола также происходит разрыв С–С связи в углеводородном заместителе и образуется бензойная кислота. Оставшаяся часть заместителя из двух атомов углерода превращается в уксусную кислоту (Г.6.30).