За счет наличия в структуре алканов только малополярных ковалентных С–Н связей и неполярных ковалентных С–С связей реакции осуществляются только в жестких условиях: облучение светом и нагревание до высокой температуры.
Большинство реакций алканов — радикальные реакции замещения, т. к. в процессе взаимодействия замещаются атомы водорода на другие функциональные группы.
1) Галогенирование
Используется только хлор Cl2 или бром Br2. Обязательное условие: облучение ультрафиолетовым светом или интенсивным излучением в видимой области спектра для образования радикалов. Происходит последовательное замещение по одному атому водорода на атом галогена, реакция проходит по свободно-радикальному механизму (Р.1.17):

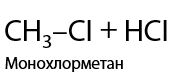

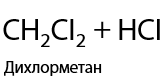
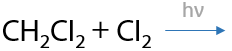
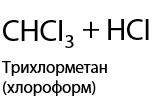
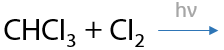
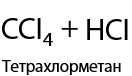
При использовании фтора происходит максимальное фторирование алкана, а с иодом алканы совсем не взаимодействуют (1.18):


При взаимодействии разветвленного или длинного (более 3 атомов углерода) алкана с хлором или бромом замещение происходит при том атоме углерода, где меньше всего атомов водорода (Е.1.19):

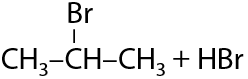
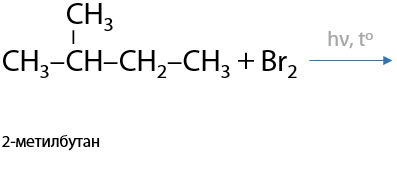
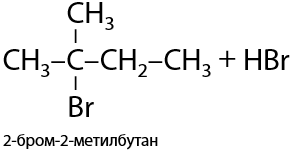
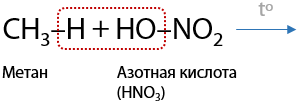
2) Нитрование
Реакция Коновалова была открыта в 1888 году. Свободно-радикальная реакция замещения атома водорода на нитрогруппу –NO2. Используется горячая азотная кислота или ее пары. Замещение проходит по правилам, характерным и для галогенирования (Е.1.20):
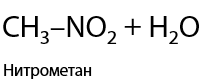


3) Дегидрирование
Важный промышленный процесс. Алканы способны отщеплять соседние атомы водорода с образованием кратных связей — двойной или тройной. Реакция проходит только на поверхности металлического катализатора Pt, Pd или Ni (Г.1.21):


При использовании алканов, начиная с гексана C6H14, возможно образование циклов — реакция циклизации (Г.1.22):

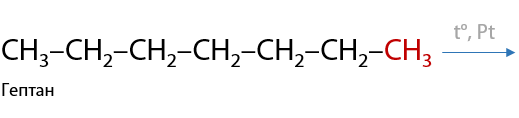
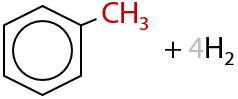
А далее из циклических алканов (циклоалканов) при тех же условиях образуются ароматические соединения (похожи на бензол) — реакция ароматизации (Е.1.23):

Важно. На экзаменах необходимо записывать только суммарный процесс получения из алканов (С6 и более) ароматических соединений (1.24):
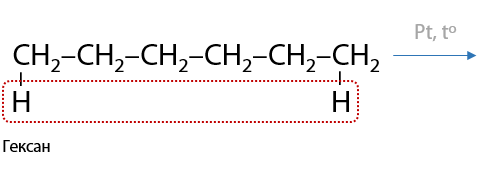

Возможно применение оксидных катализаторов вместо металлических на основе оксида хрома (III) и оксида алюминия — Cr2O3, Al2O3.
4) Изомеризация
Редкая реакция алканов, проходящая по ионному механизму (Р.1.25). Алканы, начиная с C4H10, имеют минимум 2 изомера. Переход между ними возможен с использованием хлорида алюминия или бромида железа (III).
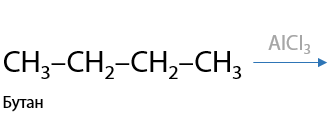

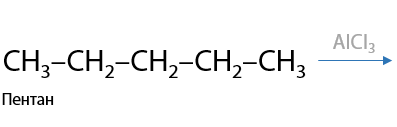
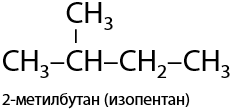
5) Крекинг
От англ. «сracking» — расщепление. Процесс высокотемпературного расщепления алканов при высокой температуре. Цель крекинга — получение алканов меньшей длины и молекулярной массы.
При нагревании без катализаторов длинных алканов «рвутся» С–С связи и образуются более короткий алкан и алкен (Г.1.27):
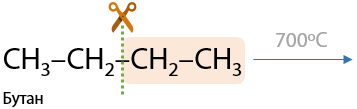
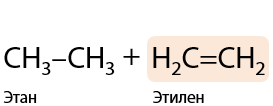
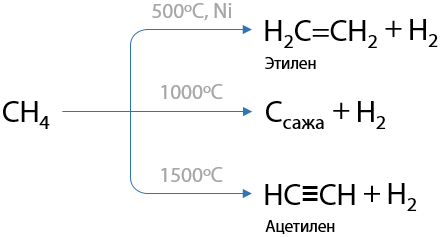
6) Пиролиз метана
Условно относится к крекингу, на самом деле — высокотемпературный пиролиз. При трех различных температурах возможно образование из метана трех различных реагентов. Реакции связывают классы алканов, алкенов и алкинов (Г.1.26):
7) Окисление
Неполное окисление — взаимодействие алканов с окислителями в мягких условиях. Не образуется углекислый газ.
7.1) Окисление бутана
Получение уксусной кислоты. Промышленный способ (Г.1.28):

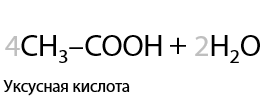
7.2) Паровая конверсия метана
Получение «синтез-газа» для синтеза синтетического бензина (Е.1.29):
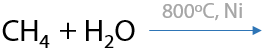
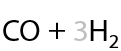
7.3) Каталитическое окисление метана кислородом
Возможно получение метанола, формальдегида или муравьиной кислоты. Все реакции проходит в присутствии катализатора и высокой температуре (Г.1.30):


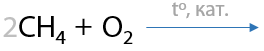
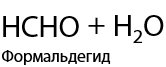
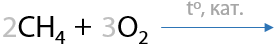
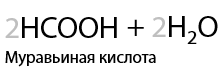
7.4) Горение
Полное окисление — горение — сопровождается выделением большого количества тепла (Г.1.31).
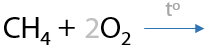
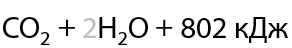


Любые органические вещества, содержащие водород и кислород, сгорают с образованием углекислого газа и воды.