Правильный ответ
- Запишем уравнения реакций
(1) AlCl3 + 3AgNO3 = Al(NO3)3 +3AgCl
(2) AlCl3 + K3PO4 = AlPO4 + 3KCl
(3) Fe(NO3)3 + K3PO4 = FePO4 + 3KNO3
- Вычислим количества данных веществ
m(AlCl3) = m(р-ра) · ω(AlCl3) = 400 · 0,0534 = 21,36 г
n(AlCl3) = m : M = 21,36 : 133,5 = 0,16 моль
n(AgCl) = m : M = 51,66 : 143,5 = 0,36 моль
- Вычислим количество вещества нитрата железа в исходном растворе
n1(AlCl3) = 1/3 n(AgCl) = 0,12 моль
n2(AlCl3) = 0,16 – 0,12 = 0,04 моль
n(AlPO4) = n2(AlCl3) = 0,04 моль
m(AlPO4) = n · M = 0,04 · 122 = 4,88 г
m(FePO4) = 15,45 – 4,88 = 10,57 г
n(FePO4) = m : M = 10,57 : 151 = 0,07 моль
n3(Fe(NO3)3) = n(FePO4) = 0,07 моль
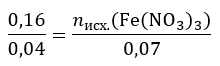
nисх.(Fe(NO3)3) = 0,28 моль
- Вычислим массовую долю нитрата железа (III)
m(Fe(NO3)3) = n · M = 0,28 · 242 = 67,76 г
ω(Fe(NO3)3) = 67,76 : 400 = 0,1694 или 16,94%
Полное решение
- Запишем уравнения реакций
(1) AlCl3 + 3AgNO3 = Al(NO3)3 +3AgCl
(2) AlCl3 + K3PO4 = AlPO4 + 3KCl
(3) Fe(NO3)3 + K3PO4 = FePO4 + 3KNO3
- Вычислим количества данных веществ
m(AlCl3) = m(р-ра) · ω(AlCl3) = 400 · 0,0534 = 21,36 г
n(AlCl3) = m : M = 21,36 : 133,5 = 0,16 моль
n(AgCl) = m : M = 51,66 : 143,5 = 0,36 моль
- Вычислим количество вещества нитрата железа в исходном растворе
n1(AlCl3) = 1/3 n(AgCl) = 0,12 моль
n2(AlCl3) = 0,16 – 0,12 = 0,04 моль
n(AlPO4) = n2(AlCl3) = 0,04 моль
m(AlPO4) = n · M = 0,04 · 122 = 4,88 г
m(FePO4) = 15,45 – 4,88 = 10,57 г
n(FePO4) = m : M = 10,57 : 151 = 0,07 моль
n3(Fe(NO3)3) = n(FePO4) = 0,07 моль
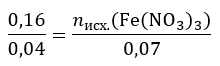
nисх.(Fe(NO3)3) = 0,28 моль
- Вычислим массовую долю нитрата железа (III)
m(Fe(NO3)3) = n · M = 0,28 · 242 = 67,76 г
ω(Fe(NO3)3) = 67,76 : 400 = 0,1694 или 16,94%